24 Mar Pilau
ISSN 2970-2321
Cette fiche a été rédigée dans le cadre du projet d’Atlas encyclopédique des Petites Iles de Méditerranée, porté par le Conservatoire du Littoral, l’Initiative PIM, et leurs nombreux partenaires.
This sheet has been written as part of the encyclopedic Atlas of the Small Mediterranean Islands project, carried out by the Conservatoire du Littoral, the PIM Initiative and their numerous partners.
(https://pimatlas.org)
ILES
Cluster : Côte Nord
Sous-bassin : TUNISIE NORD
Pilau
Contributeurs :
Aida Abdennadher (PIM), Ridha El Ouni (Consultant) et Yassine Ramzi SGHAIER (Abysse Plongée)
Date de création : Février 2022
Pour citer cette version : ABDENNADHER , A., EL OUNI, R., SGHAIER, Y-R. (2022). Fiche île : Pilau – Sous-bassin : Tunisie Nord. Atlas des Petites Iles de Méditerranée. https://pimatlas.org/explorer-atlas/iles/pilau/


| Commune | Bizerte | |
| Archipel | ||
| Surface (ha) | 6.22001 | |
| Linéaire côtier (mètre) | 1570 | |
| Distance à la côte (Mile nautique) | 1 | |
| Altitude max (mètre) | 116 | |
| Coordonnée géographiques | Latitude | 37.201617°N |
| Longitude | 10.239058° E | |
| Propriété foncière | Etat (100%) | |
| Gestionnaire(s) | Non | |
| Statut de protection | national | Non |
| international | Non | |
Description générale
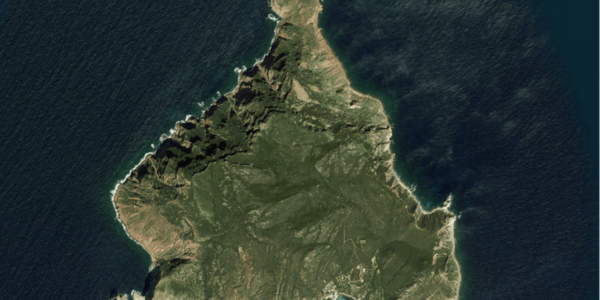
L’ile Pilau est un emblème de la plage de Rafraf, le rocher est caractérisé par sa forme qui rappelle celle d’un navire et par des changements de couleurs au moment du coucher du soleil qui sont très particuliers et qui lui confèrent l’admiration des visiteurs de la zone.
L’ile Pilau est une île rocheuse inhabitée située au nord-ouest du cap Sidi Ali El Mekki et à un mile marin au nord de la côte de Raf Raf. Culminant à 116 mètres, elle présente un sommet conique.
Connaissances

Poussin de goéland leucophée sur Pilau (Juin 2021) ©AA.
Malgré l’importance de cette île, peu d’informations sont disponibles sur sa biodiversité. Une mission d’inventaire faunistique a été menée par PIM en mai 2007 afin de mesure l’abondance des populations de micromammifères insulaires et d’évaluer les impacts rat noir sur la faune et la flore de l’ile en particulier sur l’avifaune. Le but final était de trancher sur la nécessité d’une campagne de dératisation. Les investigations ont révélé l’absence de micromammifères sur l’îlot de Pilau, sans pour autant confirmer définitivement cette absence,
En juin 2021, une mission d’exploration a été réalisée par une équipe mixte entre PIM et l’association Abysse plongée afin d’apporter des connaissances sur la biodiversité terrestre et marine de Pilau.
PARTIE TERRESTRE
Compartiment ornithologique :
Lors de la visite de juin 2021, deux colonies nicheuses d’oiseaux marins :
- Le goéland leucophée Larus michahellis: une cinquantaine d’individus ont pu être recensés lors de la visite
- Le goéland d’audouin Larus audouinii: une vingtaine d’individus ont pu être recensés lors de la visite
Pour ces deux espèces, la reproduction est bien avancée et les poussins sont âgés de quelques semaines.
Compartiment botanique
Au total, 18 espèces botaniques ont été identifiées sur l’îlot. Elles sont majoritairement distribuées sur le plateau central de l’île :
- Allium commutatum
- Asparagus albus
- Asteriscus maritimus
- Lotus cytisoides
- Limonium cf. intricatum !
- Cynomorium coccineum
- Frankenia hirsuta
- Halimione portulacoides
- Limbardia crithmoides
- Lavatera trimestris
- Matthiola tricuspidata subsp. Tricuspidata
- Mesembryanthemum nodiflorum
- Rostraria litorea
- Sarcocornia fruticosa Sedum sp.
- Capparis sp.
- Inula crithmoides
- Taraxacum officinale
- Borago officinalis
Compartiment herpétologique
Deux espèces de reptiles ont été observées: Psammodromus algirus et Chalcides ocellatus tuligugu, mais au moins trois espèces sont présentes car des traces d’un gekkonidé non-déterminé ont été notées en plusieurs endroits.
PARTIE MARINE
La ligne de rivage de l’île Pilau est rocheuse et les fonds marins proches sont peu profond (entre 3 à 5 m) caractérisés par un relief accidenté (écueils, platiers, falaises, affleurements rocheux, crique et canyons) et entourés par un large herbier de posidonie sur roche. La roche est recouverte d’algues photophiles et de posidonie en couverture dense et est très diversifiée en termes d’espèces (Padina pavonica, Corallina elongata, Jania rubens, Dictyota dichotoma, Halopteris scoparia…).
Aucune grotte sous-marine n’a été observée au niveau de l’île Pilau, cependant, la paroi présente de nombreuses cavités où un peuplement algues sciaphiles à mode battue est fortement installé.
La vie végétale domine le paysage sous-marin. Les colonies d’Astroides calycularis sont assez rares (des rares petites colonies au niveau des zones sciaphiles). Des champs de Cystoseira spp. (à domination C. mediterranea et Laurencia obtusa) en mode battu sont également assez développés et forment une ceinture presque complète de l’ile. Elles sont plus abondantes dans les parties soumises à une forte agitation (zone Nord et Nord-Ouest de l’île).
L’association avec des algues photophiles sur roche représente l’habitat le plus dominant pour la zone proche de l’ile. L’association encorbellement à Corallinales encroûtantes a une distribution verticale et reste limitée à la partie moyennement illuminée. Les herbiers à Posidonie sur roche entourent l’ile.
Un total de 26 espèces de poisson ont été également observées sur le site. La faune est dominée d’une part par des petits poissons comme les castagnoles (Chromis chromis), les saupes (Salpa salpa), les mendoles (Spicara maena), les serran-écritures (Serranus scriba) et de très jeunes individus du mérou brun (Epinephelus marginatus) et de badèche (E. costae). D’autre part, des poissons ichtivores sont également observés (Seriola dumerili, Sparus aurata, Dicentrachs labrax, Seriola dumerili). Deux individus mâles de poisson-perroquet (Sparisoma cretense) ont été également observés, probablement à la limite de la répartition de cette espèce à affinité chaude.
Intérêts











Photo de la partie Nord-est de Pilau ©H.Z (Hassen Zaghdoudi)
Depuis janvier 2021, un arrêté ministériel a permis de protéger le site archéologique de l’ile Pilau avec extension des abords de 300 m de rayon.
Vestiges archéologique à Pilau
Vestiges archéologiques sur l’ile Pilau (©A.A)
Suite aux travaux de prospection effectués par l’Institut national du patrimoine, avec l’attentif tutorat de la Surintendance de la Mer de la Région Sicile, il s’avère que l’ile constituait une zone de mouillage par excellence pour les navires depuis la plus haute antiquité. Le matériel découvert est plus ou moins homogène au niveau de la datation et de la typologie. Il consiste en du matériel d’accastillage (ancres) et d’éléments de cargaison (amphores, lingots en plomb). Ce site se distingue par la présence de plusieurs lingots de plomb et une forte concentration des amphores de type Beltran II d’origine bétique. Selon la disposition des vestiges sur le fond, il s’agit très probablement d’une épave hispanique qui témoigne de l’importance du commerce des métaux tel que le plomb au I et II s. ap. J.-C. entre la province de l’Espagne et celle de l’Afrique.
La colonie de goéland d’audouin découverte sur l’ile est à étudier de plus près car, cette espèce est inscrite en Annexe II de la liste des espèces en danger ou menacées.
Il serait également important de programmer des visites nocturnes afin de vérifier la présence de gekkonidés et d’en définir l’espece.
Les espèces sous-marines observées et inscrites dans l’Annexe II (Liste des espèces en danger ou menacées) et l’Annexe III (Liste des espèces dont l’exploitation est réglementée) protocole concernant les aires spécialement protégées et la diversité biologique en Méditerranée sont : Cystoseira mediterranea, Posidonia oceanica, Astroides calycularis, Dendropoma petraeum, Paracentrotus lividus, Epinephelus marginatus. Sciaena umbra.
Les champs de Cystoseira mediterranea en mode battu et les herbiers de posidonie en bon état de conservation constituent les habitats marins les plus remarquables de l’ile et d’intérêt pour la conservation.
Pressions







Filet fantôme retrouvé sur les fonds marins de Pilau (©YRS)
Beaucoup de déchets, notamment de plastique et de restes de visites humaines ont été remarquées sur l’ile.
Lors de la prospection de juin 2021, des files de pêche ont été observées dans la partie Sud-Est et Sud de l’ile et un filet fantôme a également été observé (Fig. 36). A noter que les poissons à Pilau ont un comportement de fuite lorsqu’ils voient un plongeur et que plusieurs juvéniles de Sars ont été rencontrés dans ces petits fonds rocheux. Ces observations tendraient à montrer que ces espèces sont soumises à une chasse sous-marine d’une part, et que ces milieux se comportent comme une nurserie (et ce pour diverses espèces de poissons) d’autre part.
Quelques espèces exotiques marines ont été inventoriées : Caulerpa cylindracea, Asparagopsis armata, Acrothamnion preissii, Oculina patagonica, Codium fragile et Percnon gibbesi. Seule Acrothamnion preissii semble avoir un caractère invasif pour les Corallinales encroûtantes.
Gestion & Conservation








Prospection de la zone de nidification des goélands sur Pilau (©N.D)
À part le statut de conservation du site archéologique subaquatique, l’ile ne bénéficie aujourd’hui d’aucun autre statut de protection. Les données sont encore fragmentaires. Des expéditions plus longues seront intéressantes à mener afin de mieux connaitre les attributs de cette ile et de mieux la protéger de l’impact humain négatif.
Principales ressources bibliographiques
- Arrêté du ministre des affaires culturelles par intérim du 21 janvier 2021, relatif à la protection de monuments historiques et archéologiques
- Le Floc’h, E., Boulos, L. & Véla, E. 2010 : Catalogue synonymique commenté de la flore de Tunisie. – Tunis.
- Pavon D. & Véla E. (2011). Espèces nouvelles pour la Tunisie observées sur les petites îles de la côte septentrionale (archipels de la Galite et de Zembra, îlots de Bizerte).
- Véla E. & Pavon D. (2012). The vascular flora of Algerian and Tunisian small islands:if not biodiversity hotspots,at least biodiversity hotchpotchs?. Biodiversity Journal, 3 (4): 343-362.
- Dutouquet, L et Abiadh, A. 2007. Contribution à l’inventaire faunistique de quelques ilots du Nord de la Tunisie. Rapport PIM 26pp.
- Delaugerre, M. et Ouni, R.. 2008. Observations herpétologiques et naturalistes sur les îles et îlots du Nord de la Tunisie; Notes ornithologiques « Oiseaux marins des îlots ». Rapport PIM, 21pp.
- Oueslati, A. (2016). Les îles de la côte nord de la Tunisie de l’intérêt d’une géomorphologie encore peu connue et étudiée : le cas de l’archipel de la Galite. Dynamiques Environnementales, 38 :160-187.