30 Mar Les illes Malgrats
ISSN 2970-2321
Cette fiche a été rédigée dans le cadre du projet d’Atlas encyclopédique des Petites Iles de Méditerranée, porté par le Conservatoire du Littoral, l’Initiative PIM, et leurs nombreux partenaires.
This sheet has been written as part of the encyclopedic Atlas of the Small Mediterranean Islands project, carried out by the Conservatoire du Littoral, the PIM Initiative and their numerous partners.
(https://pimatlas.org)
ILES
Cluster : Mallorca
Subcuenca : BALEARIC ISLANDS
Les illes Malgrats
Autores :
Rafel Mas Ferrer i la col·laboració de Mateu Oliver Munar i Eva Moragues Botey.
Fecha de creación : 31.12.2017
Para citar esta versión : MAS FERRER, R., MUNAR, M., MORAGUES BOTEY, E. (2017). Ficha isla : Illes Malgrats – Subcuenca : Baleares. Atlas of Small Mediterranean Islands. https://pimatlas.org/les-illes-malgrats/

| Ayuntamiento | Calvià | |
| Archipiélago | Mallorca | |
| Superficie (ha) | 8,41304 | |
| Lineal costero (metros) | 2135 | |
| Distancia a la costa (Millas Náuticas) | 114 | |
| Altitud máxima (metros) | 63 | |
| Coordenadas geográficas | Latitud | 39,4982 |
| Longitud | 2,45054 | |
| Propiedad | Dominio Publico Maritimo-Terrestre (20%) | |
| Organismo gestor | Direcció General d’Espais Naturals i Biodiversitat et Direcció General de Pesca i Medi Mar (Govern de les Illes Balears) | |
| Figura de protección | nacional | / |
| internacional | / | |
Descripció general
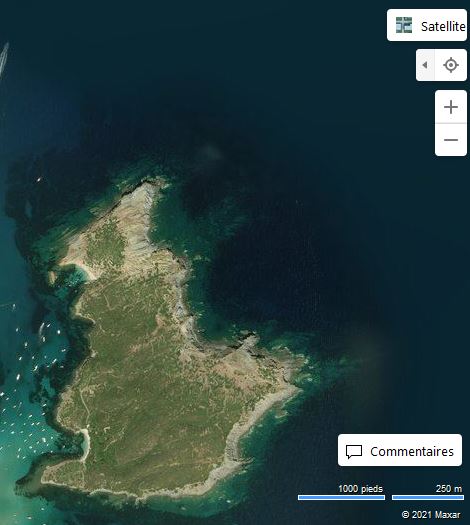
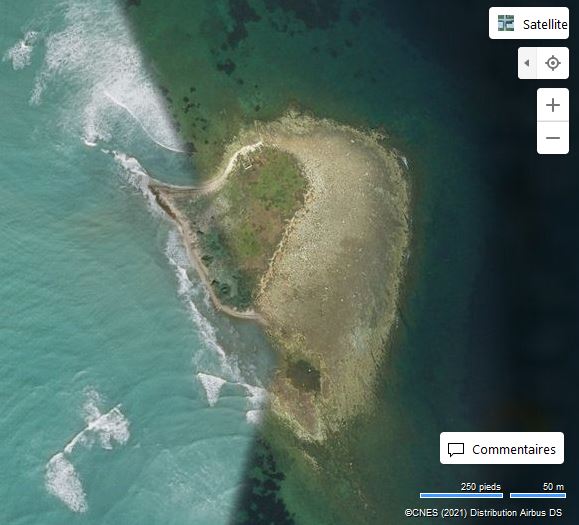
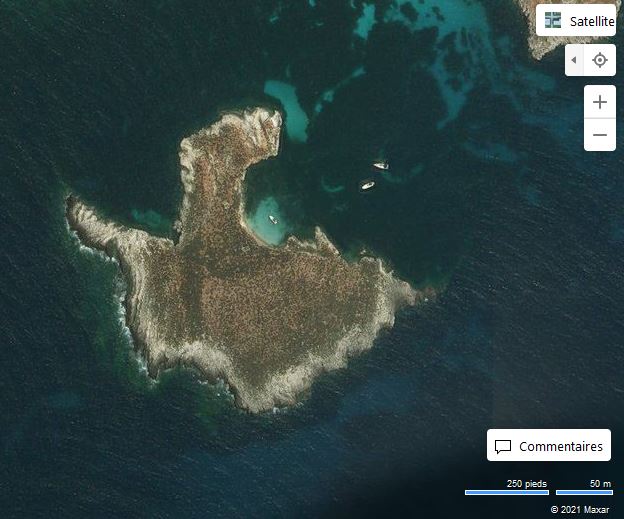
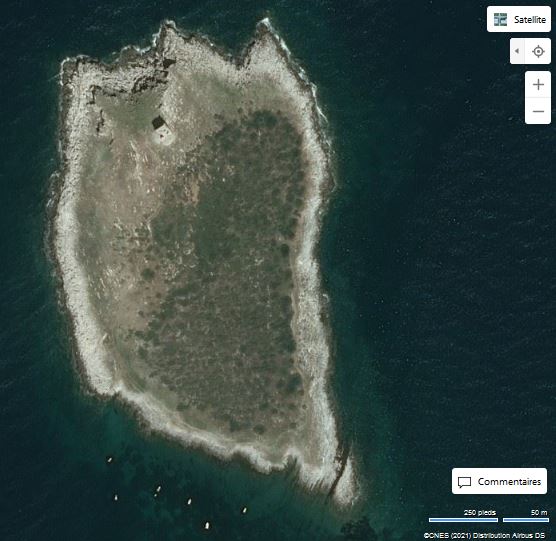
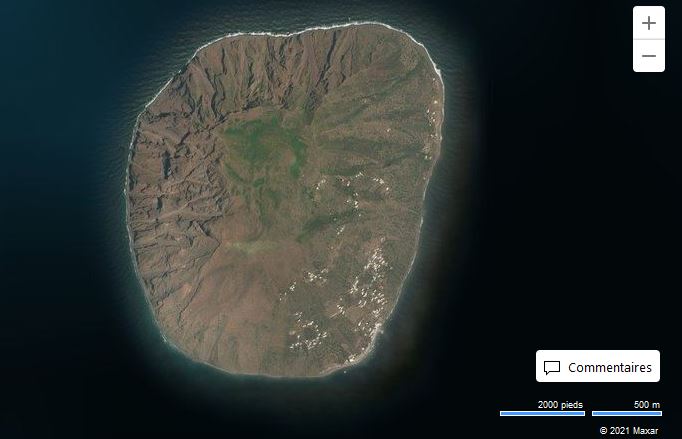
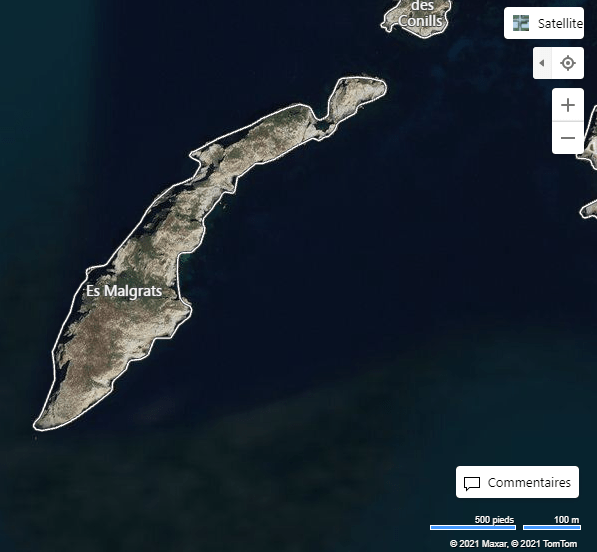
Les Malgrats són dos illots calcaris situats a escassos 180 metres de la costa del terme municipal de Calvià, pròxims a la cala de Santa Ponça. L’illot gros rep el nom des Malgrat, té aproximadament un quilòmetre de longitud i una superfície d’uns 84.200 m2. L’illot menor, anomenat illa des Conills (també és coneguda com illa de ses Rates o illa d’Enmig), té una superfície aproximada de 10.900 m2 i una amplada màxima de 170 metres. Els dos illots estan separats entre ells per 87 m. Els penya-segats de l’illa gran arriben a prop de 60 metres, mentre que l’altura de l’illa menor és de poc menys de 30 metres i presenta una línia de costa molt abrupta.
El nom de l’illa des Malgrat sembla provenir de “pas del canal”, “mal desembarcament”, “idea de desgràcia” o malgrat entès com a “castell fort” (Noguerol, 1999). Les rates i els conills eren abundants en aquests illots en el passat i probablement donen lloc al topònim de l’illot petit des Conills.
Els illots estan constituïts per materials pretectònics: dolomies i calcàries del Lias (juràssic inferior, 175-200 milions d’anys), continuació dels mateixos materials fracturats que conformen la serra de Tramuntana. Alguns d’aquests materials presenten processos erosius associats a la dinàmica litoral, es troben fracturats (orogènics) i en alguns indrets s’ha donat un procés edàfic que ha donat lloc a sòls prims i pobres. Les petites coves d’origen càrstic i fractures serveixen per a la nidificació de les aus marines. El conjunt d’illots estan orientats cap a llebeig i es Malgrat presenta unes parets verticals i abruptes a la cara nord, típiques dels materials que configuren la Serra.
Coneixement
Interessos










La vegetació adaptada a sòls salins i calents és bastant homogènia a l’illa des Conills, on predomina un tapís de salat ver, Suaeda vera, que ocupa gairebé un 80 % de la cobertura. A l’illot apareixen també algunes espècies vegetals nitròfiles, com la malva de roca, Lavatera maritima, i la vauma Lavatera arborea. A les zones més properes a la mar hi apareixen les saladines del gènere Limonium i el Mesembryanthemum nodiflorum.
La vegetació des Malgrat és també bastant pobra, amb predomini de salat ver, Suaeda vera, i amb una gran cobertura de bufera arbustiva, Withania frutescens, entre les quals apareixen intercalats exemplars d’esparreguera de gat, Asparagus albus, i d’esparreguera vera, Asparagus horridus, algunes nitròfiles, com la morella mauritànica, Parietaria mauritanica, i gramínies herbàcies. Aquest substrat herbaci es troba cobert a determinats indrets per una planta rastrera, el mantell de la Verge Maria, Fagonia cretica, que en aquest cas es comporta com a enfiladissa. Tota la vegetació està condicionada per l’acumulació de nitrogen que prové del guano i el calcigament produït per la gran colònia de gavines de peus grocs, Larus michahellis, que s’hi reprodueix. També hi és present l’endemisme tirrènic Diplotaxis ibicensis, que és molt escàs a Mallorca. A les zones pròximes on arriba una major influència de l’esprai marí s’hi troba la típica comunitat halòfila (plantes tolerants a la sal) que inclou saladines del gènere Limonium, el fonoll marí, Chritmum maritimum, i les pastanagues marines, Daucus carota subsp. commutatus.
Quant a l’avifauna, els illots encobeeixen una important colònia de cria de gavina de peus grocs, L. michahellis, que en el 2015 era de 198 parelles (Mas, et al., 2016). Els illots són també zona de descans i reproducció de corbs marins, Phalacrocorax aristotelis subsp. desmarestii, que troben a la zona de la reserva marina aliment abundant.
En les parets més empenyalades hi nidifica el falcó pelegrí, Falco peregrinus, que s’alimenta de coloms marins, Columba livia, i també hi cria el xoriguer comú, Falco tinnunculus. Però l’illa gran també és important per a petits aucells com la mèrlera, Turdus merula, el busqueret de cap negre, Sylvia melanocephala, i resulta significativa en el pas migratori per oferir aliment a diversos petits aucells passeriformes migrants, com la coablanca, Oenanthe oenathe, el vitrac Saxicola rubicola o el vitrac barbaroig, Saxicola rubetra, o limícoles de pas com la xivitona, Actitis hypoleucos, la curlera cantaire, Numenius phaeopus, o els girapedres, Arenaria interpres. També s’han observat en aquestes illes algun grup de torets, Ardeola ralloides, descansant del seu trajecte migratori i alimentant-se a les tenasses dels illots.
Les Malgrats són refugi de cria de virot petit, Puffinus mauretanicus, conegut amb una població de 300 parelles, 250 parelles as Malgrat i 50 a l’illa des Conills. També s’hi reprodueix el virot gros, Calonectris diomedea, però en un nombre molt baix i sembla que no supera 10-20 parelles (ACAP, 2016; McMinn, 2010; SKUA, 2013).
En aquests illots també hi trobam Podarcis lilfordi subsp. hartmani, una de les cinc subespècies endèmiques de sargantana balear descrites a illots de Mallorca i la qual s’avalua com a vulnerable en el Llibre vermell dels vertebrats de les Balears (Pérez Mellado, V. i Riera, N., a Viada, 2006).
Dins el grup dels invertebrats presents a aquests illots destaquen coleòpters tenebriònids, com l’escarabat pudent gegant, Blaps gigas, i altres tenebriònids endèmics com Alphasida depressa, Nesotes viridicollis subsp. viridicollis, Pachychila sublunata, Phylan semicostatus subsp. semicostatus i Stenosis intricata. Entre els caragols que trobam a aquests illots hi ha Tudorella ferruginea i el caragol endèmic balear, Xerocrassa frater subsp. frater.
Els fons marins dels voltants de les illes Malgrats inclosos dins la reserva presenten fons rocosos però, principalment, una gran extensió ben conservada de praderies de la fanerògama Posidonia oceanica, hàbitat que proporciona aliment a diversitat d’espècies de peixos.
Pressió






La zona té un interès elevat pel busseig i és molt freqüentada pels amants d’aquesta disciplina, que requereixen autorització per a gaudir-ne.
La proximitat a la costa i a Santa Ponça comporta un grau de pressió pel renou generat que afecta les espècies que hi nidifiquen, sobretot per l’illot des Conills. Aquesta situació també comporta una problemàtica associada a la contaminació lumínica, que afecta negativament els polls de virot gros i de virot petit. En el moment del seu primer vol, en què abandonen els nius, els llums de la costa provoquen que es desorientin i que hi caiguin, per la qual cosa queden exposats a diferents perills (Rodríguez, A. et al., 2015).
El fet d’estar situades entre els ports esportius del port d’Andratx i del port Adriano, ampliat recentment, fa que el trànsit d’embarcacions sigui intens, amb l’aportació conseqüent de contaminació acústica associada a les embarcacions.
Gestió i conservació







Els illots des Malgrats estan protegits per la figura d’àrea natural d’especial interès (ANEI), i formen part de la Xarxa Natura 2000 pel fet d’haver estat declarats llocs d’importància comunitària (LIC) i zona d’especial protecció per a les aus (ZEPA).
L’àrea marina dels voltants de les illes i de les aigües costaneres té un elevat valor ecològic i pesquer per la diversitat d’hàbitat i comunitats bentòniques que hi ha presents, amb unes comunitats de peixos complexes i ben conservades.
El 15 de juny del 2004, es va declarar la Reserva Marina de les Illes Malgrats, per la qual hi queden protegides 98 ha i es delimiten restriccions tant per a la pesca professional com per a la recreativa.
Principals recursos bibliogràfics
- ACAP, 2016 [consulta: 24 d’agost de 2016]
- Bioatles [consulta: 23 d’agost de 2016].
- IDEIB, 2016.
- Llorens, Ll.; Gil, Ll.; Tébar, F. J., 2007 .
- Mas, R. et al., 2015.
- McMinn, M., 2010a.
- McMinn, M., 2010b.
- Noguerol, J., 1999.
- Viada, C., 2006.
- Rodríguez, A.et al., 2015.
- Skua, Gabinet d’Estudis Ambientals SLP., 2013.