23 Août Archipel Kneiss
ISSN 2970-2321
Cette fiche a été rédigée dans le cadre du projet d’Atlas encyclopédique des Petites Iles de Méditerranée, porté par le Conservatoire du Littoral, l’Initiative PIM, et leurs nombreux partenaires.
This sheet has been written as part of the encyclopedic Atlas of the Small Mediterranean Islands project, carried out by the Conservatoire du Littoral, the PIM Initiative and their numerous partners.
(https://pimatlas.org)
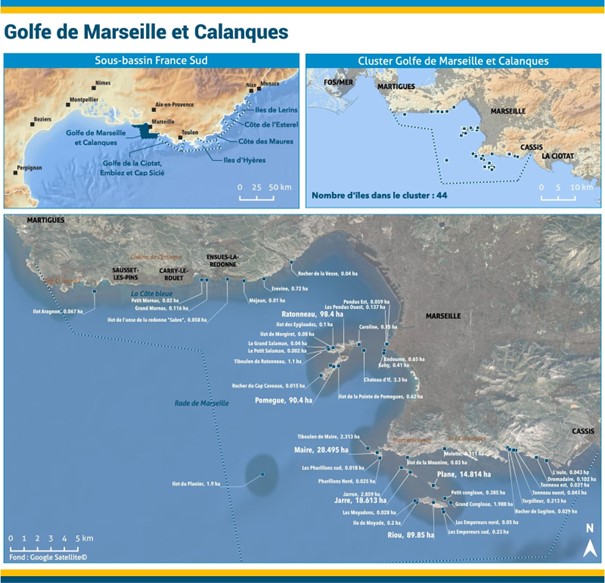
CLUSTER
Archipel Kneiss
Rédigé par : Sami BEN HAJ (initiative PIM)
Date de création : 22 février 2021
Pour citer cette version : BEN HAJ, S. (2021). Fiche cluster : Archipel Kneiss. Atlas of Small Mediterranean Islands. https://pimatlas.org/explorer-atlas/clusters/kneiss/
| Composition du cluster : îles | 5 |
| Composition du cluster : archipels | 1 |
| Nombre d’îles avec au moins un statut de protection national | 5 |
| Nombre d’îles avec au moins un statut de protection international | 5 |
| Nombre d’îles avec au moins un gestionnaire | 5 |
Description générale

©L.Charrier (11.04.2015)
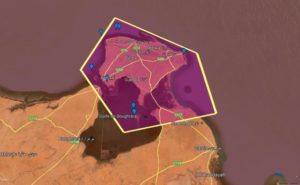
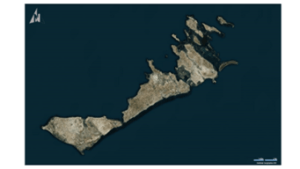
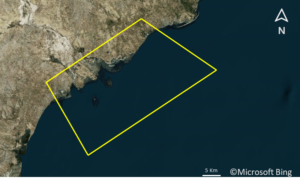
C’est un archipel de petites îles, à quelques kilomètres au large des côtes tunisiennes, à environ 50 kilomètres au sud de Sfax. L’archipel est une réserve naturelle gérée par la Direction Générale des Forêts et appelée à être érigée en Aire Marine et Côtière Protégée. Cette aire protégée s’étend sur une superficie de 14 500 ha essentiellement constituée de vasières et d’eaux peu profondes. Aujourd’hui, ils sont devenus une réserve naturelle pour de vastes vasières (14,500 hectares) et des eaux peu profondes. L’archipel constitue un habitat important pour les oiseaux marins. Les îles Kneiss font partie de l’entité marine du golfe de Gabès et bénéficient d’une identité spéciale. En effet, la zone peut être considérée comme une frontière écologique entre la Côte-Nord de la baie, dominée par les canaux de marée.
Les îles Kneiss sont en fait formées par une petite île rocheuse à la pointe de la péninsule, trois îles rocheuses situées dans la branche de Wadi Edam et la grande île.
De point de vue géomorphologique, le cap de Kneiss et les îles de Djerba forment un seuil dans la direction nord-ouest-sud-ouest (-25 m de profondeur) séparant deux zones topographiques différentes.
Cette zone géographique appartient à la zone bioclimatique de type méditerranéen aride (APAL, 2008).
En ce qui concerne la pêche, plusieurs activités sont présentes dans la zone notamment la collecte des palourdes dans la zone intertidale. Cette activité constitue une source de revenus importante pour la population locale et elle est pratiquée principalement par une main d’œuvre féminine. Cependant le stock des palourdes a connu une chute drastique et la collecte a été interdite depuis 2020.
Connaissances
 Les îles Kneiss ont fait l’objet de diverses fouilles archéologies (Poinssot, 1935 ; Sim et al., 2004 ; Trousset et al., 1992 ; Trousset 2007) et géomorphologique (Bali & Gueddari, 2011 ; Gueddari & Oueslati, 2002 ; Oueslati, 1995, 2002). En revanche, il existe peu d’informations sur le milieu naturel et la biodiversité terrestre. Ainsi que la flore vasculaire, la flore commune de Tunisie (Bonnet & Barratte, 1896 ; Cuénod, 1954 ; Pottier-Alapetite, 1979-1981) et les travaux détaillés d’écologie végétale du sud tunisien (Le Houérou, 1962) n’ont pas pu relever un inventaire détaillé et précis des îles Kneiss.
Les îles Kneiss ont fait l’objet de diverses fouilles archéologies (Poinssot, 1935 ; Sim et al., 2004 ; Trousset et al., 1992 ; Trousset 2007) et géomorphologique (Bali & Gueddari, 2011 ; Gueddari & Oueslati, 2002 ; Oueslati, 1995, 2002). En revanche, il existe peu d’informations sur le milieu naturel et la biodiversité terrestre. Ainsi que la flore vasculaire, la flore commune de Tunisie (Bonnet & Barratte, 1896 ; Cuénod, 1954 ; Pottier-Alapetite, 1979-1981) et les travaux détaillés d’écologie végétale du sud tunisien (Le Houérou, 1962) n’ont pas pu relever un inventaire détaillé et précis des îles Kneiss.
Dans l’antiquité classique, les îles Kneiss n’étaient mentionnées que dans la tournée grecque de Scylax, qui remontait au 3e ou 4e siècle av. J.-C. Les Portugais ont souligné les caractéristiques de « l’île Déserte » (D’Avezac, 1848 : p. 85).
L’auteur des « îles de l’Afrique » M. d’Avezac est le premier à décrire sommairement les iles de Kneiss. Avant lui, L. Poinssot et Ch. Saumagne ont attiré l’attention sur les traces d’un monastère dans un environnement alluvial sur une petite presqu’île près de Ras Yonga. En revanche, on peut le voir sur la petite île du milieu, un escalier de grès calcaire attaqué par l’érosion marine et qui fait partie d’un édifice ancien découvert en 1941. Parmi les autres éléments architecturaux présents sur site on signale la présence des colonnes.
L’APAL a élaboré en 2008 le premier plan de gestion de l’archipel, gérée par le ministère de l’Environnement et du Développement Durable et financé par la Banque Mondiale à travers le FEM. (APAL, 2008)
Les données relatives au couvert végétal des îles kneiss ont été représentées sous forme d’une carte de la végétation de l’île principale d’El Bessila par Cassar et al. (2002). Plus récemment, les suivis de l’initiative PIM ont permis à d’engendrer un inventaire actualisé de la flore vasculaire d’El Bessila en avril 2003 (Chaieb, 2003 ; Médail et al., 2016).
En avril 2015, l’inventaire a été réalisé sur les 5 autres îlots, ce qui a permis d’élaborer un inventaire plus exhaustif de la flore vasculaire (plantes à fleurs et fougères) des kneiss (Chaieb, 2003 ; Médail et al., 2016).
La flore vasculaire sur les îles de Kneiss est estimée à 124 espèces et sous-espèces, principalement localisées sur l’île principale El Bessila et ceci sans prendre en considération les espèces occasionnelles conditionnées aux périodes de précipitations qui peuvent dépasser les dix (Chaieb, 2003 et Médail et al., 2016).
El Bessila se caractérise par une topographie monotone de faible altitude et une grande extension des sansouïres et sebkhas qui ne favorise pas le développement d’une richesse floristique. On dénombre 74 taxons floristiques sur l’île principale et le reste des îlots ne recèle que 12 taxons.
La richesse spécifique des quatre petits îlots est assez similaire, on y trouve essentiellement deux Amaranthacées Arthrocnemum macrostachyum et Suaeda vermiculata. L’îlot El Laboua, le plus riche, abrite quatre taxons (Caroxylon tetrandrum, Halocnemum strobilaceum, Limoniastrum monopetalum, Suaeda vera) qui sont absents des trois autres îlots.
Kneïss peut être considérée comme la principale zone d’hivernage des oiseaux sur la côte méditerranéenne. En effet, BirdLife International a recensé près de 330 000 oiseaux hivernants. L’espèce la plus abondante observée à Kneïss est le Bécasseau variable, pour lequel ce site est le plus important dans la région Eurafricaine avec 125.000 individus.
Selon l’UICN, la zone abrite 13 espèces d’oiseaux d’eau où leur population biogéographique est supérieure ou égale à 1% de la population totale, à savoir : la Grande Aigrette (Egretta alba), la Spatule blanche (Platalea leurcorodia), le Flamant Rose (Phoenicopterus ruber), l’Huîtrier Pie (Haematopus ostregalus), le Gravelot à collier interrompu (Charadrius alexandrinus), le Pluvier argenté (Charadrius squatarola), le Bécasseau cocorli (Calidris ferruginea), le Bécasseau variable (Calidris alpina), le Bécasseau minute (Calidris minuta), Courlis cendré (Numenius arquata), le Chevalier Gambette (Tringa totanus), le Tournepierre à collier (Arenaria interpres) et Goéland railleur (Larus genei). (APAL, 2008).
La zone intertidale de Kneiss se caractérise par une biocénose remarquable on y trouve essentiellement, le mollusque Alexia bidentata, les crustacés Ligia italica, Orchestia gammarella et Philoscia couchii, et l’arachnide Garypus beauvoisi. Au niveau moyen, on y trouvait souvent des sphéromes et les bivalves Pirenella tricolor. L’abondance du Mytilus minimus sur les pierrailles y est aussi remarquable. Le niveau inférieur accommode souvent les canaux de marée le bivalve Cardium edule et le crustacé Leander squilla qui sont présents (Seurat, 1929 et 1934). Le bivalve Ruditapes decussatus qui a subi une pression de pêche énorme se trouve à un épuisement des stocks commercialisables dans cette région.
La pêche et l’agriculture sont les principales activités économiques de la région de Kneiss. L’activité de pêche est répertoriée essentiellement dans le port de Zaboussa, les zones côtières Khawala, Smara, Hchichina et Frichett (APAL, 2008).
Intérêts
L’importance des îles kneiss se justifie par la présence d’une biodiversité importante d’oiseaux d’eaux particulièrement des limicoles où la zone a été classée depuis 2007 comme un site RAMSAR . En effet, la zone de Kneïss est considérée comme la principale zone d’hivernage des oiseaux sur la côte méditerranéenne, selon BirdLife International près de 330 000 oiseaux hivernants sont présents sur le site. La biodiversité marine y est également distinguée. Particulièrement par les prairies des phanérogames, parmi eux, on cite 3 espèces : (Posidonia oceanica), (Cymodocea nodosa) et (Zostera noltii). Ces espèces méritent une attention particulière, car elles sont des espèces menacées et bénéficiant d’un statut particulier en méditerranée (annexe 2 du protocole ASP/DB de la convention de Barcelone).
Cette zone présente un intérêt social et économique pour la population locale. En effet, la collecte des palourdes (Ruditapes decussatus) et des couteaux (Solen marginatus) sont pratiqués par une population vulnérable et très dépendante cette activité.
Une hausse extrême des prix des appâts, principalement des annélides, a considérablement augmenté l’exploitation de ce produit ainsi que les collecteurs rendant très rentable la production.
Pressions
Les îles formant ce cluster représentent un écosystème riche cependant très fragile subissant une forte pression anthropique. C’est l’un des enjeux majeurs en termes d’aménagement.
Les populations de poissons sont menacées et les captures sont en baisse, ce qui aggrave encore l’effondrement des stocks. Ces dernières années, l’activité de pêche illégale aux alentours des îles Kneiss a considérablement développé (BOUAIN et al., 2004). Le phénomène du « Kys » a aggravé la situation dans la zone, où les autorités se trouvent incapables de pénaliser tous les utilisateurs de cet engin. En plus, les points de débarquements de la pêche au Kys sont souvent inaccessibles (Bradai et al., 1995). Cette pêche qui opère dans les faibles profondeurs détruisant l’habitat de plusieurs espèces vulnérables.
La collecte de palourdes dans la zone constitue l’activité la plus importante pour les femmes collectrices où l’activité a été suspendue depuis 2020 suite à une surexploitation des stocks dans cette zone.
L’exploitation anarchiques des appâts a contribué à la perturbation des habitats qui sont littéralement labourés.
Les risques d’introduction d’espèces non indigènes (ENI) et invasives (IAS) par les eaux de ballast au niveau du golfe de Gabès semblent être imminents. Ainsi, l’adhésion de la Tunisie à la Convention internationale sur le contrôle et la gestion des eaux de ballast et des sédiments des navires (BWM, 2004) serait une première étape pour la réduction de ces risques d’ENI, et des impacts socio-économiques et environnementaux qui peuvent en découler.
L’activité industrielle de Skhira peut être néfaste pour cet écosystème. En effet, les émissions atmosphériques des unités de production d’acide sulfurique et d’acide phosphorique qui contiennent des substances chimiques, telles que CO, CO2, NO, NO2, H2S, fluor, etc., peuvent impacter flore dans le site.
Il faut signaler aussi que ce cluster est influencé par d’autres facteurs externes, tels que l’érosion et la remontée de niveau de la mer. Le niveau actuel de la mer de cet archipel a été rapidement érodé par la mer et sa fragilité vient également de son terrain bas et des caractéristiques de vie du sol.
L’archipel de Kneiss au cœur des changements globaux
La terre a connu depuis son existence plusieurs événements (extinctions massives, glaciation, etc.) qui ont marqué l’histoire du vivant. Parmi ces événements majeurs, c’est l’élévation globale du niveau de la mer, qui menace l’humanité et met son exitance en défi dans les prochains siècles.
Au cours du dernier maximum glacier, qui remonte à 20 mille ans, le niveau de la mer se situait à environ 130 mètres du niveau actuel, et depuis, une tendance croissante est enregistrée. Cette élévation peut atteindre les 40 cm du niveau actuel en 2100, selon les prévisions du GIEC (Groupe d’experts intergouvernemental sur l’évolution du climat) dans un scénario optimiste de réchauffement climatique. Ce phénomène qui est accentué par plusieurs facteurs d’origine anthropique, impactera différemment les régions du globe, et peut mener à des crises sociales et économiques dans le monde. En 1992, lors du Sommet de la Terre à Rio, l’Organisation des Nations unies (ONU) a adopté un cadre d’action de lutte contre le réchauffement climatique : c’est la Convention-cadre des Nations unies sur les changements climatiques (CCNUCC). Elle réunit 194 pays et l’Union européenne. Depuis 1995, les COP (conférence des parties) rassemblent donc les représentants des pays, les collectivités locales, les ONG et les scientifiques. Dans le but d’adopter collectivement des solutions qui visent (1) à atténuer les causes des changements climatiques, notamment en réduisant les émissions des gaz à effet de serre (2) d’adapter des actions pour réduire la vulnérabilité des territoires et des populations face à ces changements globaux. La dernière conférence des parties, qui s’est tenue à Gasgow en 2021 (COP26) proposait que les parties s’engagent essentiellement à une transition énergétique vers des formes d’énergies propres et la réduction des émissions mondiales de méthane d’au moins 30% d’ici à 2030. En prenant en considération un soutien aux pays en développement, comme compensation puisqu’ils sont les plus touchés par les conséquences du réchauffement climatique. Et enfin, de maintenir la hausse globale des températures à 1,5°C. Cependant cette conférence propose un compromis plutôt qu’un réel changement.
En Tunisie, l’élévation du niveau de la mer a été décrite depuis l’antiquité. En effet, l’addition de multiples facteurs, comme les phénomènes d’érosion côtière et les changements eustatiques ont été en faveur de la réduction de la superficie de plusieurs archipels, notamment dans celui de Kneiss. Comme le témoignent les différents sites archéologiques retrouvés submergés aux alentours de ces îles (Paskoff et Trousset 1988). D’après les textes Ferrand, le monastère de Fulgence dans l’îlot El Labou, au centre de l’archipel de Kneiss, abritait une communauté sous la conduite de deux prêtres. Or, les dimensions réduites de l’îlot, qui ne fait qu’à peine 0.22 ha, ne permettaient pas l’installation d’une telle communauté. Ce qui laisse penser que la surface de cet archipel a été plus grande. En effet, les mentions retrouvées dans la tradition géographique arabe “surkenis qui signifia « le mur des Kneiss »”, ainsi que le texte de F. Lanfreducci et J. O. Bosio écrit vers la VI siècle, indiquaient la présence de deux îles avec bancs, la grande île ne peut être qu’« El Bessila » et les trois autres îles et îlots (El Hjar, El Laboua et El Gharbia) ont été unis sous la forme d’une île étroite et allongée sous forme d’un mur devant le littoral. Ce qui affirme que la configuration que l’archipel de Kneiss a subie depuis l’Antiquité des modifications importantes, et l’élévation du niveau de la mer va être de plus en plus palpable dans un futur proche.
Bibliographie :
- Paskoff (R.), Slim (H.) et Trousset (P.), 1991, Le littoral de la Tunisie dans l’antiquité cinq ans de recherches géo-archéologiques, CRAI, p. 515-546.
- GIEC, 2019 : Résumé à l’intention des décideurs, Rapport spécial du GIEC sur l’océan et la cryosphère dans le contexte du changement climatique [sous la direction de H.-O. Pörtner, D.C. Roberts, V. Masson-Delmotte, P. Zhai, M. Tignor, E. Poloczanska, K. Mintenbeck, M. Nicolai, A. Okem, J. Petzold, B. Rama et N. M. Weyer], sous presse.
- P. Trousset, “Kneiss”, Encyclopédie berbère, 28-29 | 2008, 4251-4254.
Gestion / conservation

©L.Charrier (11.04.2015)
Dès 1993 les îles Kneiss ont été décrétées comme une réserve naturelle. En 2001, l’archipel est répertorié sur la liste des aires spécialement protégées d´intérêt méditerranéen (ASPIM). Le 7 novembre 2007, ce cluster a été classé comme un site RAMSAR dans le cadre de la Convention sur la protection des zones humides d’importance internationale (Ramsar, 1971), et une zone d’importance pour la conservation des oiseaux (ZICO).
Le site de Kneïss avait besoin d’un statut de protection unique, qui lui fournira une stratégie de développement, tenant compte des avantages, déterminant les contraintes et organisant la gestion. Alors, en 2008, le premier plan de gestion a vu le jour et l’archipel a été proposé comme une AMCP.
En 2019, l’enquête publique a été lancée et à partir de 2020, l’APAL s’est engagé avec l’ACG (continuité des générations) dans le cadre d’un dispositif de cogestion commun à l’APAL et cette organisation sur le long terme, de l’archipel financé grâce à un fonds fiduciaire géré par MedFUND.
Principales ressources bibliographiques
-
Abdennadher A., Ramírez F., Romdhane M.S., Ruiz X., Jover L. & Sanpera C., 2010. Biomonitoring of coastal areas in Tunisia: Stable isotope and trace element analysis in the Yellow-legged Gull. Marine Pollution Bulletin, 60 : 440– 447.
- APAL, 2008. Elaboration du plan de gestion des îles Kneiss et préparation de sa mise en œuvre. Rapport définitif de première phase (Bilan socio-économique et environnemental), 116 p.
- Arrigoni P.V. & Bocchieri E., 1996. Caratteri fitogeografici della flora delle picole isole circumsarde. Biogeographia, 18 : 63-90.
- Bali M. & Gueddari M., 2011. Les chenaux de marée autour des îles de Kneiss, Tunisie : sédimentologie et évolution, Hydrological Sciences Journal, 56 : 498-506.
- Bonnet E. & Barratte G., 1896.Catalogue raisonné des plantes vasculaires de la Tunisie. Imprimerie nationale, Paris : i-xlix + 519 p.
- Boukhris A., 2015. Réponse écophysiologique de la végétation naturelle vis-à-vis de la pollution atmosphérique fluorée, dans la région aride de la Tunisie. Thèse de Doctorat en co-tutelle, Aix-Marseille Université & Université de Sfax, Marseille & Sfax : 176 p.
- Boulos L., 2005. Flora of Egypt. Volume four. Monocotyledones (Alismataceae-Orchidaceae). Al Hadara Publidhing, Cairo : 617 p.
- Brullo S., 1988. Le associazioni della classe Frankenietea pulverulentae nel Mediterraneo centrale. Acta Botanica Barcinonensia, 37 : 45-57.
- Brullo S. & Erben M., 1989. The genus Limonium (Plumbaginaceae) in Tunisia. Mitteilungen der Botanischen Statssammlung München, 28 : 419-500.
- Cassar L.F., Lanfranco E., Vassallo J., Gatt P. & Anderson E.W., 2002. Case-study: Zouara and Îles Kneiss, Tunisia. In : Scapini F. and the partners of the MECO project (eds.). Baseline research for the integrated sustainable management of Mediterranean sensitive coastal ecosystems. A manual for coastal managers, scientists and all those studying coastal processes and management in the Mediterranean. Istituto Agronomico per l’Oltremare, Florence : pp. 72-88.
- Chaieb M., 2003. Caractéristiques floristiques des Iles Kneiss. Projet de préservation de la biodiversité dans la Réserve naturelle des Iles Kneiss. Projet de micro financement TUN/98/G52/13. Rapport APNES, GEF & UNDP : 38 p.
- Church J.A. & White N.J., 2011. Sea-level rise from the late 19th to the early 21st century. Surveys in Geophysics, 32 : 585-602. Cuénod A., 1954. Flore analytique et synoptique de la Tunisie. Cryptogames vasculaires, gymnospermes et monocotylédones. Office de l’expérimentation et de la vulgarisation agricoles de Tunisie, Tunis: [1]-39 + 287 p.
- D’Avezac, 1848. Ile des Frissols. In : Îles de l’Afrique. Firmin Didot Frères, éditeurs, Paris : pp. 85-86. Damblon F. & Vanden Berghen C., 1993. Etude paléo-écologique (pollen et macrorestes) d’un dépôt tourbeux dans l’île de Djerba, Tunisie méridionale. Palynosciences, 2 : 157-172.
- Dobignard A. & Chatelain C., 2010-2013. Index synonymique de la flore d’Afrique du Nord. Volumes 1-5. Editions des Conservatoire et jardin botaniques de la ville de Genève, Genève. Doûmet-Adanson, 1888. Rapport sur une mission botanique exécutée en 1884 dans la région saharienne, au nord des grands chotts et dans les îles de la côte orientale de la Tunisie. Explorationscientifique de la Tunisie. Imprimerie nationale, Paris : iii + 124 p.
- Etienne L., Dahech S., Beltrando G. & Daoud A., 2012 : Dynamiques récentes des sebkas littorales de l’archipel des Kerkennah (Tunisie centro-méridionale) : apport de la télédétection. Revue Télédétection, 11, 273-281.
- Fennane M., Ibn Tattou M. & El Oualidi J., 2014. Flore pratique du Maroc. Manuel de détermination des plantes vasculaires. Volume 3. Dicotylédones (p.p.), Monocotylédones. Travaux de l’Institut scientifique, Série botanique, 40, Rabat : xi + 795 p.
- Gueddari M. & Oueslati A., 2002. Le site des Kneiss, Tunisie : géomorphologie et aptitudes à l’aménagement. In : Scapini F. (ed.), Recherche de base pour une gestion durable des écosystèmes sensibles côtiers de la Méditerranée. Istituto Agronomico per l’Oltremare : pp. 63-71.
- Kharrat-Souissi A., Baumel A., Mseddi K., Torre F. & Chaieb M., 2010. Polymorphism of Cenchrus ciliaris L. a perennial grass of arid zones. African Journal of Ecology, 49 : 209–220.
- Lambinon J., 2000. Additions et corrections à la liste des plantes vasculaires de l’île de Djerba (Tunisie méridionale). Bulletin de la Société d’échange des plantes vasculaires d’Europe et du bassin méditerranéen, 28 : 127-143.
- Lanza B. & Poggesi M., 1986. Storia naturale delle isole satelliti della Corsica. L’Universo, Firenze, 66 : 1-198.
- Le Houérou H.-N., 1955 : Contribution à l’étude de la végétation de la région de Gabès. Notice détaillée de la carte des groupements végétaux de Gabès–Sidi Chemmakh. Annales du Service botanique et agronomique de Tunisie, 28, 141-179 + 7 planches et 1 carte h.-t.
- Le Houérou H.-N., 1962. Recherches écologiques et floristiques sur la végétation de la Tunisie méridionale. Mémoire hors-série de l’Institut de recherches sahariennes, 6. Première partie, les milieux naturels, la végétation : 281 p. Seconde partie, la flore : 229 p. + 3 cartes et tableaux h.-t.
- Louvel J., Gaudillat V. & Poncet L., 2013. EUNIS, European Nature Information System, Système d’information européen sur la nature. Classification des habitats. Traduction française. Habitats terrestres et d’eau douce. MNHN-DIREV-SPN, MEDDE, Paris : 289 p.
- Mantran R., 1977. La description des côtes de la Tunisie dans le Kitâb-i Bahriye de Piri Reis. Revue de l’Occident musulman et de la Méditerranée, 24 : 223-235.
- Médail F., Pasta S. & Chaieb M., 2015a. Flore et végétation des îles et îlots satellites de l’archipel des Kerkennah (Tunisie orientale). Bilan de la biodiversité végétale terrestre, impacts environnementaux et recommandations de gestion. Note naturaliste PIM, Aix-en-Provence : 66 p.
- Médail F., Charrier L., Charrier M., Doxa A., Pasta S. & Chaïeb M., 2015b. Vulnérabilité de la biodiversité végétale face à l’élévation du niveau marin : le cas des petites îles et îlots de Tunisie orientale. In : Beltrando G., Dahech S., Daoud A. & Etienne L. (eds.), Vulnérabilité des littoraux méditerranéens face aux changements environnementaux contemporains. Actes du symposium international, Kerkennah (Tunisie) du 20 au 24 octobre 2015, Sfax : pp. 227- 236.
- Modéran Y., 1998. Fulgence de Ruspe. In : Encyclopédie berbère, vol. 19 (Filage – Gastel). Aix-en-Provence, Edisud : pp. 2939-2944. URL : http://encyclopedieberbere.revues.org/1975
- Monchicourt C. (ed.), 1925. Lanfreducci & Bosio, Costa e discorsi di Barberia. Rapport maritime, militaire et politique sur la côte d’Afrique, depuis le Nil jusqu’à Cherchell par deux membres de l’Ordre de Malte (1er septembre 1587). Revue africaine, 66 : 419-549.
- Morrison L.W., 2014. The small-island effect: empty islands, temporal variability and the importanceof species composition. Journal of Biogeography, 41 : 1007-1017.
- Oueslati A., 1995. Les îles de la Tunisie. Paysages et milieux naturels. Centre d’Etudes et de Recherches Economiques et Sociales (CERES). Série géographique, n° 10, Tunis : 368 p.
- Oueslati A., 2002. Erosion destructrice et érosion réparatrice : le cas des Kneiss en Tunisie. In : CIESM (ed.). Erosion littorale en Méditerranée occidentale : dynamique, diagnostic et remèdes. CIESM Workshop Series, 18 : pp. 59-62. www.ciesm.org/publications/Tanger02.pdf
- Paskoff R. & Sanlaville P., 1983. Les côtes de la Tunisie. Variations du niveau marin depuis le Tyrrhénien. Travail réalisé dans le cadre de l’ERA 345 du CNRS. Collection de la Maison de l’Orient et de la Méditerranée, 14. Série géographique et préhistorique, 2. Maison de l’Orient, Lyon, 192 p.
- Pignatti S., 1982. Flora d’Italia. Edagricole, Bologna, vol. 1, 790 p.; vol. 2, 732 p.; vol. 3, 780 p.
- Pirazzoli P.A., 1986. Secular trends of relative sea level (RSL) changes indicated by tide-gauge record. Journal of Coastal Research, special issue 1 : 1-26.
- Poinssot L., 1935. Les îles Kneiss et l’archéologie. Bulletin archéologique du Comité des Travaux historiques, 1934- 1935 : 323-333.
- Pottier-Alapetite G., 1979-1981. Flore de la Tunisie. Publications scientifiques tunisiennes. Programme flore et végétation tunisiennes, Tunis. Vol. 1, Dicotylédones (p.p.) : [Salicacées – Ombellifères] : [i]-xix + 1-651. Vol. 2, Dicotylédones (fin) : [Ericacées – Composées] : [i]-xiv +655-1190.
- Pretto F., Celesti-Grapow L., Carli E., Brundu G. & Blasi C., 2012. Determinants of non-native plant species richness and composition across small Mediterranean islands. Biological Invasions, 14 : 2559-2572.
- Price R.G., Jaoui K., Pearson M.P. & de Grissac A., 2014. An alert system for triggering different levels of coastal management urgency: Tunisia case study using rapid environmental assessment data. Marine Pollution Bulletin, 80 : 88-96.
- Quézel P. & Santa S., 1963. Nouvelle flore de l’Algérie et des régions désertiques méridionales. Tome II. C.N.R.S., Paris : pp. 571-1170 + 70 planches h.-t.
- Raimondo F.M., Domina G. & Spadaro V., 2010. Checklist of the vascular flora of Sicily. Quad. Bot. Amb. Appl., 21 : 189-252.
- Slim H., Trousset P., Paskoff R. & Oueslati A., 2004. Le littoral de la Tunisie. Étude géoarchéologique et historique. CNRS Editions, Paris : 308 p. Vanden Berghen C., 1981. Liste commentée des plantes vasculaires observées dans l’île de Djerba (Tunisie méridionale). Lejeunia, 105 : 1-38.
- Vidal E., Médail F. & Tatoni T., 1998. Is the yellow-legged gull a superabundant bird species in the Mediterranean? Impact on fauna and flora, research priorities and conservation measures. Biodiversity and Conservation, 7 : 1013- 1026.
- Trousset P., 2008. Kneiss (îles). In : Encyclopédie berbère, vol. 28-29 (Kirtēsii – Lutte). Edisud, Aix-en-Provence : pp. 4251-4254. URL : http://encyclopedieberbere.revues.org/99
- Trousset P., Slim H., Paskoff R. & Oueslati A., 1992. Les îles Kneiss et le monastère de Fulgence de Ruspe. Antiquités africaines, 28 : 223-247.
- Weigelt P., Steinbauer M.J., Sarmento Cabral J. & Kreft H., 2016. Late Quaternary climate change shapes island biodiversity. Nature, http:dx.doi.org/10.1038/ nature17443
- Whitehead D.R. & Jones D.E., 1969. Small islands and the equilibrium theory of insular biogeography. Evolution, 23 : 171–179.
Tableau récapitulatif des clusters et îles du sous-bassin
| NOM DES ILES
ET ILOTS |
NOM DE L’ARCHIPEL | surface (ha) | Altitude max (mètre) | Linéaire côtier (mètre) | Distance à la côte (mile nautique) | Coordonnées géographiques | Propriété | Iles avec au moins un statut de protection | Présence d’un gestionnaire | |
| Latitude | Longitude | |||||||||
| El Bessila | Archipel des Kneiss | 436 ha | 7 | 11087 | 1.67 | 34.36639023 | 10.31444454 | Publique | Oui | Oui |
| El Hajar | 0.017 | 3 | 51.6 | 2.83 | 34.34277725 | 10.29083347 | Publique | Oui | Oui | |
| El Laboua | 0.0227 | 3 | 1173.4 | 3.16 | 34.32749939 | 10.28194427 | Publique | Oui | Oui | |
| El Gharbia Nord | 0.191 | 3 | 297.8 | 3.5 | 34.321281 | 10.276461 | Publique | Oui | Oui | |
| El Gharbia Sud | 0.53 | 4 | 400 | 3.6 | 34.31999969 | 10.27499962 | Publique | Oui | Oui | |





 Le cluster de l’archipel d’El Biban fait partie de l’écosystème de la lagune d’El Biban, caractérisée par plusieurs intérêts.
Le cluster de l’archipel d’El Biban fait partie de l’écosystème de la lagune d’El Biban, caractérisée par plusieurs intérêts.