07 Juin Tunisie Est
ISSN 2970-2321
Cette fiche a été rédigée dans le cadre du projet d’Atlas encyclopédique des Petites Iles de Méditerranée, porté par le Conservatoire du Littoral, l’Initiative PIM, et leurs nombreux partenaires.
This sheet has been written as part of the encyclopedic Atlas of the Small Mediterranean Islands project, carried out by the Conservatoire du Littoral, the PIM Initiative and their numerous partners.
(https://pimatlas.org)
SOUS-BASSIN
TUNISIE EST
Rédigé par : Sami Ben Haj
Date de création : février 2022
Pour citer cette version : BEN HAJ, S. (2022). Fiche sous-bassin : Tunisie Est. Atlas of Small Mediterranean Islands. https://pimatlas.org/explorer-atlas/sous-bassins/tunisie-est/
| Secteurs insulaires | Iles retenues pour les fiches |
| – Cluster Kuriat | Grande Kuriat ; Petite Kuriat |
| – Cluster KERKENNAH | Roummadiya ; Sefnou ; Lazdad ; Charmadia ; Gremdi |
| – Cluster KNEISS | El Bessila / Grande Kneiss ; Laboua |
| – ILOTS SATELLITES DE DJERBA | Dzira ; El Gataïa el Bahria ; El Gataïa el Gueblia ; Jlij ; Lella Hadhria Nord |
| – EL BIBAN |
1. Présentation et caractéristiques générales
1.1 Caractéristiques générales :

Îles et îlots sans relief, planes avec couvert végétal adapté à la salinité et à l’aridité (R. Ouni, 2015)
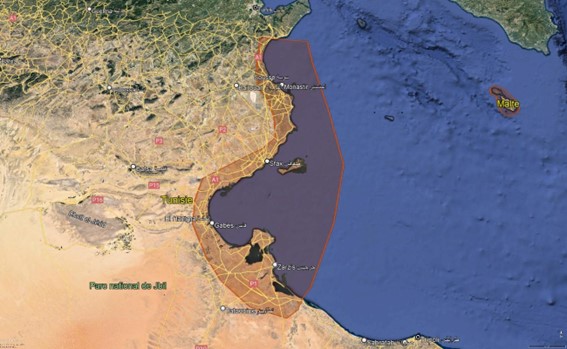
Le sous-bassin Tunisie-Est comporte 45 îles et îlots réparties sur l’ensemble des côtes Est de la Tunisie. Elles s’étalent sur un polygone dont le point le plus extrême du côté Nord se situe à 35°79’ (Grande Kuriate) alors que le dernier point côté Sud se situe à 33°26’ (Ilot 12 de l’archipel El Biban).
A part l’archipel des îles Kuriates et celui des îles Kerkennah, tous les autres îlots et îles du sous-bassin sont très proches de la côte. Kerkennah est la plus éloignée de la côte sur une distance de 15 miles nautique puis la grande Kuriate située à 9,1 miles nautiques. L’îlots d’El Enf, situé dans la baie de Monatstir, est le plus proche de la côte. Il est rattaché directement à la ligne côtière (O Mile nautique).
Administrativement, les îles et les îllots du sous bassin Est appartiennent à quatre gouvernorats :
-
- L’archipel des îles Kuriates, îlots des pigeons, îlots d’El Enf et îlot de Dimass ou de Thapsus Font partie du territoire du gouvernorat de Monastir.
- Les îlots de Chebba (Kaboudia, inconnu et Jebel) et îlot EL Far font partie du gouvernorat de Mahdia.
- L’archipel de Kneiss et l’archipel des îles Kerkennah appartiennent au territoire du gouvernorat de Sfax.
- Les îles du cluster de Djerba et celui d’El Biban sont liées administrativement au gouvernorat de Medenine.
La surface totale de ces îles est de 1667,63 ha, l’île d’El Bessila ou Grande kneiss est la plus grande avec 436 ha suivie de la grande Kuriate avec 251,3 ha constituant à elles seules plus de 41% de la superficie insulaire du sous-bassin. La majorité des îlots de ce sous-bassin sont de petites surfaces et dont la taille est inférieure à 1 ha (14 îlots). 10 îlots ont une surface émergée comprise entre 1 et 10ha.
Toutes les îles du sous-bassin est présentent une topographie plane sans reliefs remarquables. L’altitude maximale ne dépasse pas les 10m pour enregistrée au niveau de l’îlot el Hmam (ilot des pigeons ou ilot des colombes) situé à l’extrême nord du cluster des îles Kuriates. L’îlot d’El Bessila présente une altitude de 7m.
Vu leurs structures planes et non accidentées, les études relatives à la géologie et la topographie des différentes îles et îlots de sous-bassin est sont relativement rares voir absentes pour certaines localités.
La nature géologique du substrat des îles Kuriat est caractérisée principalement par la présence de grés et de roches carbonatées couverts de matériaux sableux déposés par la mer ou sablo-vaseux en provenance des sebkhas. Il s’agit principalement de formations quaternaires très récentes appartenant au pliocène supérieur constituée par des grés jaune coquillier qui affleurent dans les parties les plus élevées septentrionales de l’île. Sur ces grés repose en discordance, un grès oolithique rappelant le faciès de la formation Rejiche caractéristique de la côte sahélienne. Cette dernière correspond à un cordon littoral consolidé marquant la position du rivage il ya 125 000 ans. La mer avait franchi la ligne actuelle du rivage et les îles devaient se trouver sous l’eau et appartenir de ce fait a un ancien haut fond (Oueslati, 1995)
L’examen de la carte géologique des Kerkennah montre la prépondérance des formations meubles, en particulier les limons rouges du Würm (Pléistocène supérieur) qui s’étendent sur environ 39 % de la superficie totale. Sur les 181 kilomètres qui forment la longueur totale des côtes de l’archipel, 84 km (soit 46 %) sont taillés dans les limons rouges, sous forme de microfalaises dont la dénivellation ne dépasse guère les 30 à 60 cm (Delteil, 1982).
Du point de vue géomorphologique, pour les îles de Kneiss, un domaine de plaines, un domaine de bas plateaux et un domaine de collines se succèdent entre la mer et le continent ; l’évolution géomorphologique a légué une variété de formes et de modèles, d’une grande valeur scientifique et patrimoniale. Du côté de la mer, la topographie basse du continent passe insensiblement à un milieu original : les bancs de Kneiss qui correspondent à des hauts-fonds caractérisés par leur grande platitude (Gueddari et Oueslati).
L’île de Djerba se présente comme un Caillou plat posé sur la mer. Le relief faible est formé d’alignements NW – SE de dômes de croûte villafranchienne ; entre ces alignements on trouve des sols plus profonds formés sur un sable d’origine tyrrhénienne (Boyer, 1968).
Le cluster d’el Biban est situé dans un ensemble géologique dénommé « Bassin de Gabès », dont le cadre géologique est dominé par un substratum constitué de dolomies, calcaires et argiles crétacées. Le bord de mer est le plus souvent constitué de dunes côtières grésifiées du Thyrhénien marin, qui isolent des sebkhas ou se sont déposés des sédiments marins récents peu profonds, lagunaires, avec couches salées.
Le sous-bassin Est de la Tunisie longe toute la côte Est et Sud du pays d’où une large différence des conditions climatiques d’une localité à une autre.
Par leur position insulaire, les Kuriat sont très ventées, les situations calmes ne dépassent pas 15% des observations. Les coups de vents proviennent du secteur Nord et surviennent pendant la saison fraîche avec des vitesses souvent supérieures à 20 m/s. Les vents maxima enregistrés atteignent des vitesses considérables de l’ordre de 50 m/s (Sellami, 2010).
La température moyenne annuelle enregistrée dans la ville de Monastir est de l’ordre de 20 °C. L’amplitude thermique entre les moyennes des mois le plus froid (janvier) et le plus chaud (août) est relativement modérée (15.4 °C).
Pour l’archipel de Kneiss, La pluviométrie annuelle moyenne est de 180mm, la température moyenne de 19°C.
Concernant l’archipel de Kerkennah, le régime thermique est de type Méditerranéen chaud avec une moyenne annuelle des températures de l’ordre de 18,8 °C. Les écarts thermiques sont atténués par rapport au continent proche et ceci en raison de la proximité de la mer. Les températures maximales sont enregistrées au mois d’août, alors que les minimales sont observées au mois de janvier avec des températures pouvant avoisiner 0°C. Les vents dominants secouant l’archipel Kerkennien sont de secteur Ouest et Nord-Ouest notamment durant l’automne et l’hiver. Les vents des secteurs Sud-Ouest et Nord sont aussi fréquents.
Pour la zone d’El Biban, les vents dominants sont de secteur Ouest et Nord en hiver et en automne et de secteur E et NE en été et au printemps. La brise marine dominante en été est orientée globalement E-O et atteint son maximum vers minuit. Cette brise a pour effet principal d’accentuer les mouvements de la marée montante et de pousser les eaux de la lagune jusqu’en zone supra tidale. Les vitesses des vents les plus fréquentes sont généralement de 2 à 4 m/s.
1.2 Contexte écologique et patrimoine naturel :

Les herbiers à Posidonia oceánica – Kuriat
Le cluster La Kuriat – Chebba se caractérise par un statut écologique exceptionnel. En effet, il abrite plusieurs espèces végétales et animales à haute valeur écologique est patrimoniale. La posidonie, espèce endémique de la méditerranée d’une grande valeur écologique et économique, est largement distribuée sur les fonds marins de l’Archipel de Kuriat où il s’étend entre 0 et 27 m (Ben Mustapha, 1992).
Les fonds de maërl, caractérisés par les algues calcaires arbusculaires ou laminaires libres tels que les genres Lithothamnion, Lithophyllum et Mesophyllum, sont situés dans les parties rocheuses au Nord des deux îles kuriat ainsi qu’à l’Ouest de la petite Kuriat à des profondeurs très faibles, de 0.5 à 7 m. La présence de cette formation à de telles profondeurs montre que le milieu est sous influence des courants de fond.
Une grande densité d’éponges (Ircinia spp, Sarcotragus spp), entre 0 et 2 m de profondeur caractérise le secteur Nord et Nord-ouest de la grande Kuriat ainsi que la façade Nord-ouest et Ouest de la petite Kuriat. Ce faciès de la roche littorale est intéressant d’autant plus qu’il est rare de trouver d’aussi importantes densités en Méditerranée (2 à 5 individus/m²), à l’exception des hauts fonds des îles Kerkennah.
La tortue caouanne Caretta caretta est l’espèce emblématique des îles Kuriat. En Tunisie et spécifiquement aux îles Kuriat, la ponte peut s’étendre d’avril à septembre sur les plages de sable fin mais le suivi de la nidification sur la grande Kuriat de 1993 à 1999 a permis de situer la période de ponte de Caretta caretta principalement aux mois de juin et de juillet de chaque année (Jribi, 2002a).
L’avifaune, à son tour, constitue un potentiel biologique important qui caractérise le cluster la Kuriat – Chebba. Plusieurs espèces ont été identifiées sur l’archipel de Kuriat à savoir le flamant rose Phoenicopterus ruber, du grand cormoran, Phalacrocorax carbo et du Héron cendré Ardea cinerea. De plus, l’île constitue aussi un abri pour un certain nombre d’autres oiseaux marins, comme le goéland d’Audouin Larus audouinii, le goéland Leucophé Larus cachinnans, le gravelot à collier ininterrompu Charadrius alexandrinus et la sterne pierregarin Sterna hirundo.
L’herpétofaune des îles Kuriat n’a pas été recensée d’une manière exhaustive. Elle est formée essentiellement de serpents ainsi que des Lacertidæ, qui sont des prédateurs des œufs d’oiseaux et des tortues marines.
La zone marine du cluster de Kneiss est dotée d’une riche végétation marine (composée notamment d’herbiers de Cymodocea nodosa) qui supporte des populations très riches de poissons et de coquillages, notamment la palourde. Mais le principal intérêt biologique de la zone réside dans les énormes effectifs d’oiseaux d’eau, en particulier les limicoles, (chiffres maximaux dépassant 300.000 individus) qui y séjournent pendant différentes périodes de l’année.
Dans la littérature, il a été indiqué que Kneiss abrite des espèces d’oiseaux gravement menacées d’extinction tel que ourlis à bec grêle Numenius tenuirostris (CR) (Fishpool & Evans, 2001).
L’archipel des Kerkennah est caractérisé par une présentation particulière de l’herbier de Posidonie qui est connu sous le nom d’herbier tigré. Ce type d’herbier est étroitement lié à la phanérogame marine Cymodocea nodosa et d’autres algues vertes comme Caulerpa prolifera et Halimeda tunaI.
Pour l’avifaune, les Kerkennah sont classées comme une zone Importante pour la Conservation des Oiseaux (zone ZICO) notamment ses zones intertidales insulaires (estran) qui sont très importantes pour les espèces hivernantes ou de passage. En effet, un tiers de la superficie totale de l’archipel est constitué par des Sebkhas et des dépressions salées : ces milieux constituent une zone d’hivernage recherchée (présence permanente d’eau) pour de nombreux oiseaux qui viennent nicher, notamment pour des espèces comme le grand cormoran Phalacrocorax carbo, les goélands (Larus genei, Larus fuscus, Larus cachinnans) et les sternes (Sterna caspia, Sterna sandvicensis)
Quant à l’archipel d’El Biban, les écosystèmes marins dans les alentours sont très diversifiés et constitués principalement des habitats à phanérogames marines à Posidonia oceanica et Cymodocea nodosa ainsi que des vastes prairies d’algues. L’ichtyofaune marine est très diversifiées et elle est représentée par plus de 60 espèces dont la majorité est à haute valeur commerciale.
1.3 Occupation humaine ancienne et histoire de l’environnement :

Phare de la grande Kuriat
Au niveau de l’archipel des îles Kuriat, le phare de la grande île témoigne une forme récente de la présence humaine. Actuellement, ce phare est sous la tutelle de ministère de défense tunisienne en tant qu’une structure de contrôle et de surveillance.
D’autres traces de présence humaine ont été relevées remontant à la préhistoire. En effet, dans le voisinage immédiat du phare, construit à la fin du 19ème siècle, des fragments fossilisés d’œufs d’Autruche et des éclats de silex retouchés ont été découverts. Il s’agit probablement d’une industrie néolithique comme l’atteste la présence de pièces caractéristiques de cette civilisation, tels les trapèzes et les retouches envahissantes. Des témoins d’occupations encore plus récentes révèlent des vestiges de thonaires (madragues) dans les Kuriat.
La multiplicité des vestiges éparpillés dans l’archipel des îles kuriat témoigne d’une présence phénicienne depuis le 12ème siècle av. J.C. Les Phéniciens, peuple tourné vers la mer, ont développé une économie basée sur le commerce et l’agriculture et ont considérée l’archipel de Kerkennah comme un comptoir et un lieu d’escale pour les navires venant de l’orient. Ensuite, après la fondation de Carthage en 814 av. J. C., les phéniciens se sont installés à Kerkennah et ont construit la ville et le port de Cercina (à El H’sar) sur la côte Ouest de Kerkennah. L’historien grec Hérodote au 5ème siècle a qualifié Kyrannis (Kerkennah) d’île prospère et de l’importance de ses vignobles et ses oliviers ainsi que son important port de commerce. Ainsi, les vestiges puniques sont importants à Kerkennah tels que les tombes puniques au sous-sol de Karraba près de Borj El H’sar et à Mellita (Fehri A., 2000 et 2003).
Au niveau de l’archipel de Kneiss, un monastère où avait séjourné l’évêque de Ruspe a été localisé. Fulgence de Ruspe, ou saint Fulgence, né à Thélepte en 462, 467 ou 468 et mort à Ruspe (en) le 1er janvier 527 ou 533, fut évêque de la ville antique de Ruspe en Tunisie, à l’époque en Byzacène romaine dominée par les vandales.
Une prospection systématique, réalisée dans le cadre du programme tuniso-français d’étude du littoral de la Tunisie dans l’antiquité, a donné l’occasion de reconnaître l’ensemble du banc des Kneiss – côté terre et côté îles – et de confirmer la localisation du monastère dans l’îlot du milieu (Dzirat el Laboua) de l’archipel des Surkenis, au sud de la grande Kneiss (Dzirat el Bessila).
La majorité des îlots du cluster de Djerba sont de très petites tailles (<1ha) et ne montrent pas de vestiges de passage humain. Par contre, la grande île de Djerba est très riche en monuments et vestiges qui témoignent le passage de différentes civilisations tel que celles des Grecs, Phéniciens et Chartagénois.
Il est aussi important de citer que l’île de Djerba est caractérisée par le grand Phare de Taguermess qui est mis en service depuis aout 1985.
2. Usages contemporains et pressions
2.1 Usage domaine terrestre

Occupation de la plage en été – Kuriat
La principale utilisation du domaine terrestre de la plupart des îles du sous bassin Est de la Tunisie est le tourisme. En effet, les excursions pédestres des randonneurs et des groupes de touriste se sont bien développées surtout durant la dernière décennie. Les principales îles fréquentées par les touristes sont l’île Kuriat, les îles Kerkennah et l’île de Djerba.
L’archipel des îles Kuriat est exploité, illégalement sur sa partie terrestre par des promoteurs touristiques qui y ont établi des équipements d’accueil sommaire (sur la petite île) et revendiquent même l’extension des espaces aménagés pour l’exercice de leur activité, notamment sur la grande île qui leur est encore interdite.
L’île de Djerba est la plus touchée par ce facteur qui ne cesse de se développer à travers la multiplication du nombre des unités hôtelières sur le littoral de l’île ainsi que l’installation d’un port de plaisance à Houmet Souk.
Il est important aussi de signaler que l’île de Djerba et l’archipel Kerkennah abritent plusieurs ports de pêches (2 ports à Kerkennah et 3 à Djerba).
La deuxième utilisation terrestre de certaines îles du sous bassin est l’agriculture. Cette pratique est étroite relation avec la présence des populations humaines sur ces îles durant l’histoire pour leurs fournir leurs besoins. Les îles de Kerkennah et de Djerba sont les principales îles du sous bassin nord sur lesquelles l’agriculture a été pratiquée.
2.2 Usage domaine marin

Pêche à la Charfiya aux îles Kerkennah
La pêche est la principale activité pratiquée dans tous les alentours des différentes îles et îlots du sous bassin nord. La richesse des fonds marins rend de ses localités des zones attrayantes pour les pêcheurs qui ciblent les différentes espèces existantes et en utilisant différentes techniques de pêche. Malgré les efforts déployés par l’état tunisien pour protéger ces zones sensibles, la pêche reste toujours la principale menace à faire face pour conserver le potentiel écologique de ces localités.
Les îles Kerkennah sont connues par une pratique de pêche artisanale typique de cette localité « pêche à la charfiya ». Cette technique est pratiquée sur presque toute la zone côtière d l’île à des faibles profondeurs.
L’archipel des îles Kneiss est connue par la pêche à pied de la palourde Reditapes decussatus qui constitue la principale activité des femmes pratiquée dans la vasière de l’île El Bessila.
Pour les îlots du cluster El Biban, ils sont caractérisés par un système de pêche artisanale unique en Méditerranée « les bordigues » qui sont des systèmes de capture de poissons installés entre les différents îlots et dont l’installation remonte au 19ème siècle.
Le tourisme balnéaire est à son tours une activité bien développée sur les rives de la majorité des îles de sous-bassin Est. Des navettes régulières sont organisées durant toute la saison estivale en direction des îles kuriat venant de la ville de Monastir.
3. Etat des connaissances sur la biodiversité et enjeux de conservation
3.1 Etat domaine terrestre :

La flore terrestre aux îles Kerkennah et Djerba
a) Astragalus pseudosinaicus Gazer & Podlech sur l’île Gataia el Gueblia (Djerba), 07.IV.2015 (cliché M. Charrier); b) Filago congesta DC. récolté sur l’île Gremdi (Kerkennah), 27.III.2014 (herb. F. Médail, AIX), (cliché D. Pavon); c) F. fuscescens Pomel récolté sur l’île Roumadiya (Kerkennah), 28.III.2014 (herbier F. Médail, AIX), (cliché D. Pavon); d, e) Narcissus obsoletus (Haw.) Steud. sur l’île Roumadiya (Kerkennah), 22.X.2015 (clichés F. Médail).
L’état de connaissance sur la biodiversité terrestre diffère d’une localité à une autre. Tout dépend du nombre des études qui se sont intéressées au suivi biologique sur la partie continentale. Généralement, plusieurs études scientifiques ont été réalisées dans le cadre des initiatives des petites îles de méditerranée (initiatives PIM) ainsi que d’autres travaux de recherche et qui ont aboutis à la publication de rapports ou notes scientifiques. Le degré de connaissance ou de richesse spécifique terrestre dépend étroitement de la taille et de la morphologie terrestre de chaque île ou îlot.
La conservation des parties terrestres devrait se renforcer surtout pour les îles dont les parties continentales sont très fréquentées. Le plus grand enjeu de conservation terrestre est la possibilité d’avoir des équipes de surveillance et de gestion installées d’une manière permanente durant toute l’année sur les îles pour contrôler la fréquentation et la gérer d’une manière durable.
3.2 Etat domaine marin :

Herbier frangeant de posidonie aux îles Kerkennah
L’état de connaissance du domaine marin des différentes îles et îlots du sous-bassin Est est variable d’une localité à une autre.
L’archipel des îles kuriat est très bien étudié suite à plusieurs missions de suivi et de diagnostic lors de la réalisation d’un plan de gestion environnemental et social spécifique pour cette zone. De même, la présence d’une équipe de cogestion installée depuis 2015 a abouti à la publication de plusieurs données sur les écosystèmes marins ainsi que sur la richesse spécifique marine. L’avifaune des îles Kuriat est bien connue et dénombrée et chaque année elle bénéfice des missions de dénombrement organisées par les spécialistes tunisiens et étrangers.
L’archipel de Kneiss a fait, à son tours, l’objet de plusieurs études scientifiques qui se sont intéressés à la caractérisation de la faune et la flore marine dans les alentours. Son classement en tant que zone humide RAMSAR depuis 2007 a attiré encore plus les chercheurs à s’approfondir dans les études des écosystèmes marins et la biocénose associée.
Le domaine marin de l’archipel des îles Kerkennah est bien connu suite à plusieurs travaux scientifiques qui ont été réalisées par des chercheurs ou bien dans le cadre de l’élaboration d’un plan de gestion environnemental et social. De même, l’archipel est classé comme site RAMSAR depuis 2012 ce qui renforce l’état de connaissance.
Pour l’île de Djerba, les études qui les ont ciblés sont limitées d’où un état de connaissance faible. Les données existantes donnent une idée générale et pas un inventaire détaillé de la biodiversité marine.
Pour les îlots d’El Biban, malgré que leurs surfaces soient relativement petites, le domaine marin est bien connu. Plusieurs études se sont intéressées aux écosystèmes marins, aux espèces de poisson exploitées ainsi qu’à l’avifaune typique de cette localité.
3.3 Pressions
Le sous-bassin est de la Tunisie est soumis à plusieurs formes de pressions dont l’impact varie d’une localité à une autre.
Le tourisme est la pression la plus remarquable qui menace l’équilibre écologique au niveau de l’archipel des îles kuriat et Djerba.
La pêche illicite est à son tour une pression exercée au niveau de tous les îlots et îles de sous-bassin. L’utilisation de technique de pêche destructives et non sélectives à des faibles profondeurs et sur les rives des îles constitue un vrai danger pour les écosystèmes marins et la biodiversité marine.
Au niveau de îles kneiss, la surpêche de la palourde a entrainé une diminution remarquable dans le stock exploitable par la population locale et plus précisément les femmes spécialisées dans ce métier.
La pollution est aussi un autre facteur qui ne cesse de s’accentuer dans le grand golfe de Gabès qui couvre la plus grande partie du sous-bassin Est. La pollution, d’origine continental, menace directement les habitats et les écosystèmes des îles qui sont très proches de la côte comme le cas des Kneiss. Ces derniers sont soumi aux effets de l’activité industrielle du gouvernorat de Sfax dont les polluants sont directement déversés en mer.
La spécificité de la topographie et la morphologie des différentes îles du sous-bassin Est (faible altitude) les rend très sensibles à un phénomène qui ne cesse de menacer toute la planète : le changement climatique. Ce facteur qui engendre une augmentation continue de la température de surface ainsi que l’élévation du niveau de la mer rend tout le sous-bassin vulnérable. Une grande partie des îlots et îles à basse altitude sont menacés par l’immersion à moyens et long terme.
A ce facteur s’ajoute le phénomène de marnage qui caractérise le golfe de Gabès et qui peu dépasser les 150cm. C’est phénomène unique en Méditerranée qui aggrave encore la situation des habitats côtiers comme les zones humides.
4. Statut de conservation et gestion
Le statut de conservation varie d’une localité à une autre du sous-bassin Est de la Tunisie.
L’archipel des îles Kuriat a bénéficié d’un plan de gestion environnemental et social qui est actuellement en phase d’actualisation. Un projet de classement de cet archipel en tant que AMCP est en cours de réalisation. Le site dispose d’un premier plan de gestion, à la suite d’un projet MECO financé par la Commission Economique Européenne «Bases pour un aménagement intégré durable d’écosystèmes côtiers méditerranéens sensibles» et dont les Iles Kneiss étaient un des cas d’étude.
L’archipel de kneiss est une réserve naturelle par l’arrêté du Ministre de l’Agriculture du 18 décembre 1993 (publié sur le Journal Officiel de la République Tunisienne 100, page 2389, du 31 décembre 1993). Il est aussi classé comme zone humide RAMSAR et il fait partie de la liste des Aires Spécialement Protégées d’Intérêt Méditerranéen (ASPIM).
L’archipel des îles Kerkennah est classé comme une réserve naturelle. Un plan de gestion de la partie marine des îlots Nord a été élaboré dans le cadre de la création d’une AMCP.
Le site est classé comme Aire Importance pour la conservation des oiseaux d’eau (‘Important Bird Area’) par l’association mondiale ‘Bird life International’ ou Association des Amis des Oiseaux (AAO) depuis 2001. En 2012, les zones humides de l’archipel ont été classées comme zones RAMSAR.
Sur le plan législatif, la gestion des îlots de l’archipel d’El Biban doit être assurée par l’agence de protection et d’aménagement du littoral (APAL). Sur le plan pratique, aucune équipe de gestion n’est installée pour assurer la gestion et la surveillance de l’archipel. Le suivi et le contrôle est limité aux actions générales qui intéressent toute la lagune d’El Biban – principalement les organisations en charge des pêcheries. Il est important de signaler que l’archipel d’El Biban a fait l’objet d’une étude pour l’élaboration d’un plan de gestion.
Le cluster le l’archipel d’El Biban ne fait pas l’objet d’un statut de protection spécifique. Par contre il fait partie d’un écosystème classé comme site Ramsar : la lagune d’El Biban (TN1697). L’importance du site pour les oiseaux a été marquée par le classement de la lagune par BirdLife comme Zone Importante pour la Conservation des Oiseaux (ZICO/IBA), site TN 044 (Fishpool & Evans 2001).
Le cluster de Djerba ne dispose d’aucun statut de conservation. Deux sites ont été classés comme RAMSAR depuis 2007 : Djerba Ras Rmel et Djerba Bin El Wedian.
5. Stratégie de conservation
L’Agence de Protection et d’Aménagement du Littoral a lancé une enquête publique auprès des autorités locales ayant pour objectif la création officielle des AMCP. Dans le sous bassin Est de la Tunisie, les archipels des îles Kurait et de Kneiss sont les localités qui font l’objet de cette enquête et qui vont bénéficier d’un statut juridique officiel à la fin de cette étape.
Principales ressources bibliographiques
-
Ben Mustapha K., 1992. Les herbiers de Posidonie du littoral tunisien I- Le Golf de Hammamet. Notes nouvelle série Nº2 INSTOP Salammbo.
-
Boyer J. 1968. Etude pédologique du cheikat de Ofar (Ile de djerba)
-
Delteil J. 1982. Le cadre néotectonique de la sédimentation plio-quaternaire en Tunisie centrale et aux îles Kerkennah. Bulletin de la Société Géologique de France, 7ème série, p.187-193.
-
Fehri A., 2000. Kerkena : Histoire et Société. Édit. Centre Cercina et FLSH de Sfax, Sfax, 197 p.
-
Fehri A., 2003. Kerkena de Cercina à Hached. Centre Cercina pour les recherches sur les Iles Méditerranéennes. Série Rives méditerranéennes, livre 3, 210 p.
-
Fishpool L D C & M L Evans (eds) (2001): Important Bird Areas in Africa and associated islands: Priority sites for conservation. Newbury and Cambridge, UK: Pisces Publications and BirdLife International (BirdLife Conservation Series No 11).
-
Jribi, I., Bradai, M.N. & Bouain, A. 2002a. Marine Turtle Nesting in Kuriat Islands, Tunisia, 2000. Mar. Turtle Newsl., 96 : 4-6.
-
Oueslati A., 1995. Les îles de Tunisie: paysages et milieux naturels. Numéro 10 de Cahier du C.E.R.E.S.: Série géographique Publications de l’Université de Tunis: Géographie ; 367 pages.
Gueddari M & A Oueslati : Le site des Kneiss, Tunisie : Géomorphologie et aptitudes à l’aménagement. Baseline research for integrated sustainable management in sensitive Mediterranean coastal sites; report of EEC MECO project, pp 63-71.
| NOM DU CLUSTER | NOM DES ILES
ET ILOTS |
NOM DE L’ARCHIPEL | surface (ha) | Altitude max (mètre) | Linéaire côtier (mètre) | Distance à la côte (mile nautique) | Coordonnées géographiques | Propriété | Iles avec au moins un statut de protection | Présence d’un gestionnaire | |
| Latitude | Longitude | ||||||||||
| Kuriat – Chebbab | Ilot de Kaboudia, îlot de Rass Kabo, Gataya | 22,087 | 2 | 3300 | 0,027 | 35,225835 | 11,158252 | Etat – domaine public maritime (100%) | APAL (ministère de l’environnement) | ||
| ilot inconnu | 0,89 | 400 | 0,603 | 35,215442 | 11,158727 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Jebel | 7,308 | 2800 | 1,157 | 35,208789 | 11,16558 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot de Dimass ou de Thapsus, Ras Dimes | 16 | 3 | 6600 | 0 | 35,63583374 | 11,04083347 | N/A | APAL (ministère de l’environnement) | |||
| Ilot d’el Enf | 20 | 4200 | 0 | 35,72916794 | 10,83055592 | N/A | APAL (ministère de l’environnement) | ||||
| Ilot d’el Far | 4,2 | 3 | 900 | 0,4 | 35,15611267 | 11,09666634 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot el Hmam, ilot des pigeons,ilot des colombes | 0,89 | 10 | 360 | 0,05 | 35,78888702 | 10,83361149 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ile Kuriat (Grande), Qûriya el Kbira | 251,3 | 4 | 6900 | 9,1 | 35,79694366 | 11,03305531 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ile Kuriat (Petite), Qûriya es Sghira, Conigliera | 49,6 | 4000 | 7,1 | 35,76750183 | 11,00833321 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot de Kaboudia, îlot de Rass Kabo, Gataya | 22,087 | 2 | 3300 | 0,027 | 35,225835 | 11,158252 | Etat – domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| ilot inconnu | 0,89 | 400 | 0,603 | 35,215442 | 11,158727 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Jebel | 7,308 | 2800 | 1,157 | 35,208789 | 11,16558 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot de Dimass ou de Thapsus, Ras Dimes | 16 | 3 | 6600 | 0 | 35,63583374 | 11,04083347 | N/A | APAL (ministère de l’environnement) | |||
| Ilot d’el Enf | 20 | 4200 | 0 | 35,72916794 | 10,83055592 | N/A | APAL (ministère de l’environnement) | ||||
| Ilot d’el Far | 4,2 | 3 | 900 | 0,4 | 35,15611267 | 11,09666634 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot el Hmam, ilot des pigeons, ilot des colombes | 0,89 | 10 | 360 | 0,05 | 35,78888702 | 10,83361149 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Kerkennah | Gremdi, Ile Rhermedi | 206 | 3 | 8880 | 20 | 34,7555542 | 11,32111073 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||
| Roummadiya | 159 | 4 | 9176 | 19 | 34,81999969 | 11,31583309 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Sefnou | 50 | 4 | 4752 | 15 | 34,79583359 | 11,22416687 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Rakkadiya, Ramadiya | 4 | 2 | 1099 | 18 | 34,82416534 | 11,28138924 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Lazdad | 34 | 3815 | 20 | 34,76805496 | 11,29777813 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Charmadia, ech Charmandia | 3 | 2 | 722 | 15 | 34,76750183 | 11,20666695 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| La Première, El Oula | 2,21 | 785 | 22 | 34,757164 | 11,302829 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| l’Amandier, ilot Lzadad Ouest, El Louza | 1,18 | 521 | 19,54 | 34,77194 | 11,293015 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Haj Hamida, El Hadj Hamida, Jeblia | 1,43 | 648 | 23,07 | 34,75763 | 11,362424 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Keblia | 0,99 | 495 | 23,1 | 34,75291 | 11,360442 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Rocher du milieu, El Wousta, Hjar el Ouest | 0,13 | 168 | 22,63 | 34,753459 | 11,351503 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| El Gharsa, Ilot du jardin, Gharsa | 1,64 | 633 | 22,43 | 34,758369 | 11,350458 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ecchima, Chehimi | 0,06 | 114 | 22,25 | 34,757392 | 11,344791 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Kneiss | El Bessila, Grande Kneiss | 436,24 | 7 | 11087 | 1,67 | 34,36639023 | 10,31444454 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | ||
| El Hajar, El Hjar, îlot Nord | 0,017 | 3 | 51,6 | 2,38 | 34,34277725 | 10,29083347 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| Laboua, El Oustaniya, El Laboua, El Wassta, ilot Centre | 0,227 | 3 | 173,4 | 3,16 | 34,32749939 | 10,28194427 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| Gharbia Sud, El Gharbia Sud, El Rharbia, Ilot Sud | 0,53 | 4 | 400 | 3,6 | 34,31999969 | 10,27499962 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| El Rharbia, Ilot Sud,EL Gharbia Nord | 0,191 | 3 | 297,8 | 3,5 | 34,321281 | 10,276461 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| El Bessila, Grande Kneiss | 436,24 | 7 | 11087 | 1,67 | 34,36639023 | 10,31444454 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| El Hajar, El Hjar, îlot Nord | 0,017 | 3 | 51,6 | 2,38 | 34,34277725 | 10,29083347 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| Laboua, El Oustaniya, El Laboua, El Wassta, ilot Centre | 0,227 | 3 | 173,4 | 3,16 | 34,32749939 | 10,28194427 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| Gharbia Sud, El Gharbia Sud, El Rharbia, Ilot Sud | 0,53 | 4 | 400 | 3,6 | 34,31999969 | 10,27499962 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| El Rharbia, Ilot Sud,EL Gharbia Nord | 0,191 | 3 | 297,8 | 3,5 | 34,321281 | 10,276461 | Etat – Domaine public maritime (100%) | Direction Générale des Forêts (Ministère de l’Agriculture)/APAL (ministère de l’environnement) | |||
| Ilots satellites de Djerba | Ilot de Borj Jilidj,Dzira | 2,44 | 3 | 906 | 12,087 | 33,87497 | 10,73973 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||
| Ilot Est d’El Ghala | 0,1102 | 1 | 164 | 14,74 | 33,90089 | 10,79914 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| El Gataïa el Bahria,Guettaiet el Baharia,Ilot Cattaya | 153,21 | 5 | 9200 | 1,06 | 33,73222351 | 10,71527767 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| El Gataïa el Gueblia,Guettaiet el Gueblia | 72,81 | 2 | 4639 | 1,62 | 33,69138718 | 10,77388859 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Jlij,Ilot Djellidji | 149,29 | 1 | 5830 | 2,42 | 33,59638977 | 10,86722183 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot Jlij Centre | 1,43 | 2 | 621,96 | 3,14 | 33,579093 | 10,868933 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot Jlij Sud | 0,288 | 2 | 218,7 | 3,27 | 33,57732 | 10,869666 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Lella Hadhria Nord | 0,5 | 3 | 345 | 11,22 | 33,790329 | 11,060915 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Lella Hadhria Sud | 0,31 | 1 | 271,5 | 11,11 | 33,788723 | 11,062066 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot de Sidi Salem | 0,0286 | 119 | 14,882 | 33,89938 | 10,81134 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot de Borj Jilidj,Dzira | 2,44 | 3 | 906 | 12,087 | 33,87497 | 10,73973 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot Est d’El Ghala | 0,1102 | 1 | 164 | 14,74 | 33,90089 | 10,79914 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| El Gataïa el Bahria,Guettaiet el Baharia,Ilot Cattaya | 153,21 | 5 | 9200 | 1,06 | 33,73222351 | 10,71527767 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| El Gataïa el Gueblia,Guettaiet el Gueblia | 72,81 | 2 | 4639 | 1,62 | 33,69138718 | 10,77388859 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Jlij,Ilot Djellidji | 149,29 | 1 | 5830 | 2,42 | 33,59638977 | 10,86722183 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot Jlij Centre | 1,43 | 2 | 621,96 | 3,14 | 33,579093 | 10,868933 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot Jlij Sud | 0,288 | 2 | 218,7 | 3,27 | 33,57732 | 10,869666 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Lella Hadhria Nord | 0,5 | 3 | 345 | 11,22 | 33,790329 | 11,060915 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Lella Hadhria Sud | 0,31 | 1 | 271,5 | 11,11 | 33,788723 | 11,062066 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot de Sidi Salem | 0,0286 | 119 | 14,882 | 33,89938 | 10,81134 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| EL Biban | Ilot 1 de l’archipel El Biban | 1,4 | 740 | 4 | 33,27777863 | 11,29472256 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | |||
| Ilot 2 de l’archipel El Biban | 0,1 | 80 | 4 | 33,27694321 | 11,29583359 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 3 de l’archipel El Biban | 0,1 | 30 | 4 | 33,27750015 | 11,29638863 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 4 de l’archipel El Biban | 1,4 | 600 | 4 | 33,2761116 | 11,29749966 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 5 de l’archipel El Biban | 0,4 | 150 | 4 | 33,2761116 | 11,29916668 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 6 de l’archipel El Biban | 0,3 | 110 | 4 | 33,27639008 | 11,29972267 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 7 de l’archipel El Biban | 1,9 | 600 | 4 | 33,27472305 | 11,30222225 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 8 de l’archipel El Biban | 1,4 | 730 | 4 | 33,27305603 | 11,30472183 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 9 de l’archipel El Biban | 3,4 | 1200 | 4 | 33,27249908 | 11,3077774 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 10 de l’archipel El Biban | 0,1 | 160 | 4 | 33,270751 | 11,310244 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| ilot de sidi Mohammed Chaouch | 3 | 770 | 4 | 33,26861191 | 11,3125 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 11 de l’archipel El Biban | 0,3 | 240 | 4 | 33,26833344 | 11,3166666 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 12 de l’archipel El Biban | 1,2 | 780 | 4 | 33,26638794 | 11,31999969 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 1 de l’archipel El Biban | 1,4 | 740 | 4 | 33,27777863 | 11,29472256 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 2 de l’archipel El Biban | 0,1 | 80 | 4 | 33,27694321 | 11,29583359 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 3 de l’archipel El Biban | 0,1 | 30 | 4 | 33,27750015 | 11,29638863 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 4 de l’archipel El Biban | 1,4 | 600 | 4 | 33,2761116 | 11,29749966 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 5 de l’archipel El Biban | 0,4 | 150 | 4 | 33,2761116 | 11,29916668 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 6 de l’archipel El Biban | 0,3 | 110 | 4 | 33,27639008 | 11,29972267 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 7 de l’archipel El Biban | 1,9 | 600 | 4 | 33,27472305 | 11,30222225 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 8 de l’archipel El Biban | 1,4 | 730 | 4 | 33,27305603 | 11,30472183 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 9 de l’archipel El Biban | 3,4 | 1200 | 4 | 33,27249908 | 11,3077774 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 10 de l’archipel El Biban | 0,1 | 160 | 4 | 33,270751 | 11,310244 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| ilot de sidi Mohammed Chaouch | 3 | 770 | 4 | 33,26861191 | 11,3125 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 11 de l’archipel El Biban | 0,3 | 240 | 4 | 33,26833344 | 11,3166666 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||
| Ilot 12 de l’archipel El Biban | 1,2 | 780 | 4 | 33,26638794 | 11,31999969 | Etat – Domaine public maritime (100%) | APAL (ministère de l’environnement) | ||||










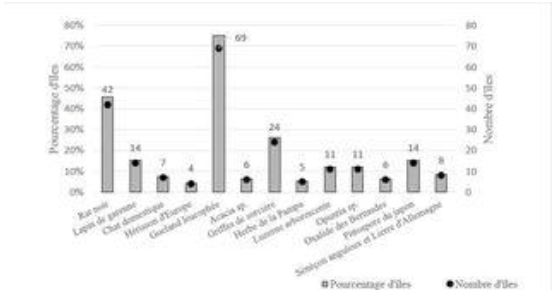
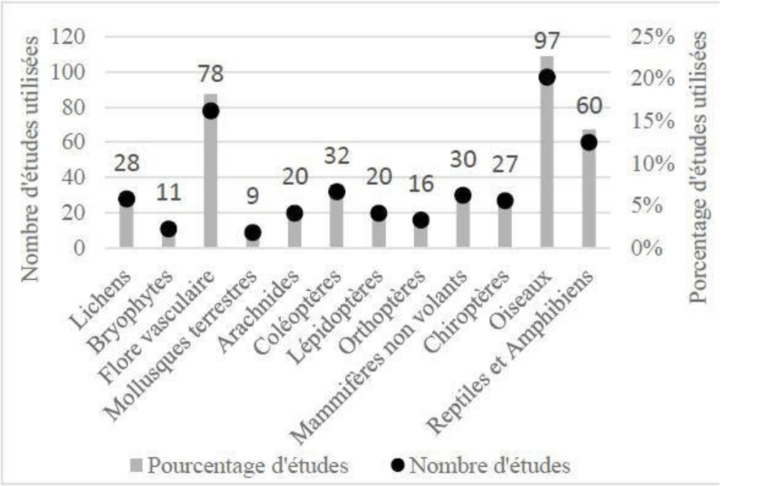
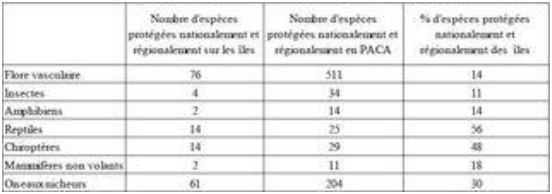
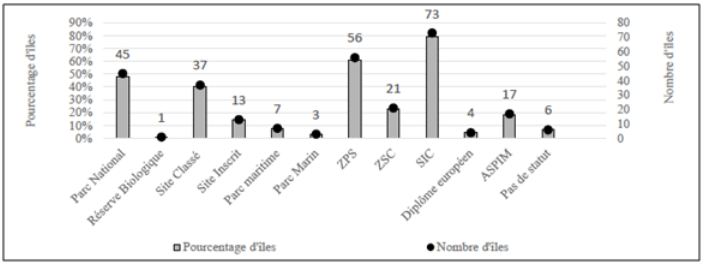 Figure 5. Bilan du nombre et du pourcentage d’îles et îlots (n = 92) selon les différents statuts de protection, d’après Fouchard (2013).
Figure 5. Bilan du nombre et du pourcentage d’îles et îlots (n = 92) selon les différents statuts de protection, d’après Fouchard (2013).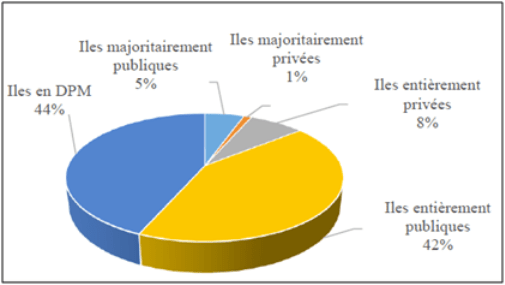 Figure 6. Répartition des statuts fonciers, en pourcentage, des îles et îlots de Provence-Côte d’Azur, d’après Fouchard (2013).
Figure 6. Répartition des statuts fonciers, en pourcentage, des îles et îlots de Provence-Côte d’Azur, d’après Fouchard (2013).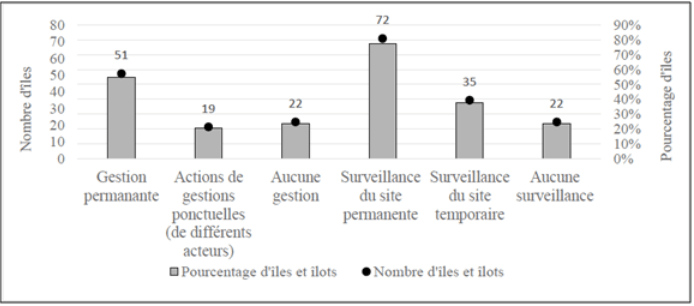 Figure 7. Bilan du nombre et du pourcentage d’îles selon les différents types de gestion ou de surveillance du site (n = 92 îles), d’après Fouchard (2013).
Figure 7. Bilan du nombre et du pourcentage d’îles selon les différents types de gestion ou de surveillance du site (n = 92 îles), d’après Fouchard (2013).





