ISSN 2970-2321
Cette fiche a été rédigée dans le cadre du projet d’Atlas encyclopédique des Petites Iles de Méditerranée, porté par le Conservatoire du Littoral, l’Initiative PIM, et leurs nombreux partenaires.
This sheet has been written as part of the encyclopedic Atlas of the Small Mediterranean Islands project, carried out by the Conservatoire du Littoral, the PIM Initiative and their numerous partners.
(https://pimatlas.org)
SOTTOBACINO
SARDEGNA
Collaboratori :
Gianluigi Bacchetta (CCB, HBK), Claudia Corti (UNIFI), Elena Desiderà (AMP Tavolara), Giuseppe Fenu (CCB), Mauro Fois (CCB), Augusto Navone (AMP Tavolara), Giovanna Spano (AMP Tavolara), Pieraugusto Panzalis (AMP Tavolara), Giulia Ceccherelli (AMP tavolara), Rosangela Picciau (CCB), Marco Porceddu (CCB, HBK), Mariano Ucchesu (CCB)
Data di creazione : 3 Aprile 2018
Per citare questa versione : BACCHETTA, G., CORTI, C., DESIDERA, E., FENU, G., FOIS, M., NAVONE, A., SPANO, G., PANZALIS, P., CECCHERELLI, G., PICCIAU, R., PORCEDDU, M., UCCHESU, M.(2018). Foglio di sottobacino : Sardegna . Atlas of Small Mediterranean Islands. https://pimatlas.org/explorer-atlas/sous-bassins/sottobacino-sardegna/
| Clusters di isole | Isolotti descritti |
| – Isole Tavolarine | Isola di Tavolara; Isola di Molara |
| – Arcipelago di La Maddalena | Isola di Spargi; Isola Rossa di Trinità d’Agulto |
| – Arcipelago dell’Asinara | Isola Piana dell’Asinara |
| – Isole della Riviera del Corallo | |
| – Isole della Costa di Bosa | |
| – Isole del Sinis | Isola di Mal di Ventre |
| – Isole dell’Iglesiente | Isola di Pan di Zucchero |
| – Arcipelago Sulcitano | Isola del Toro |
| – Isole della Costa del Sud | Isola Rossa di Punta Niedda |
| – Arcipelago dei fiori e isole d’Ogliastra | Isola di Serpentara |
1. Descrizione e caratteristiche generali
1.1. Caratteristiche principali
Il sottobacino « Sardegna », situato al centro del Mediterraneo occidentale, occupa una superficie di 24.089 km2 che comprende la principale isola di Sardegna (23.821 km2), 213 piccole isole, più altre tre maggiori (Asinara, San Pietro e Sant’Antioco). In totale, il perimetro costiero della Sardegna e delle isole minori risulta pari a 1.846 km.
Il sottobacino dista 178 km da Cap Serrat (Tunisia) e 188 km dall’Argentario (Toscana, Italia). Il Mar di Sardegna separa l’Isola ad occidente dall’Arcipelago spagnolo delle Baleari (circa 340 km da Minorca) e dalla Penisola Iberica (circa 430 km da Stintino alle coste catalane), mentre più vicine risultano a nord ovest le coste Provenzali (circa 275 km da Stintino). L’isola francese della Corsica, la quarta isola del Mediterraneo per estensione (8.681 km2), dista invece solo circa 11 km dalle coste di Santa Teresa di Gallura.
Dal punto di vista geologico, le formazioni più antiche dell’Isola hanno età comprese tra il Precambriano ed il Paleozoico superiore. In particolare, la fase orogenica ercinica ha prodotto deformazioni tettoniche collegate a fenomeni di metamorfismo e magmatismo (intrusivo ed effusivo). L’insieme di queste rocce, di età compresa tra 500 e 250 milioni di anni (M.a.), forma il “Basamento Ercinico Sardo” che costituisce circa un terzo della superficie della Sardegna e rappresenta la successione Paleozoica più completa tra quelle affioranti in Italia. A differenza della vicina Corsica, dove i suoi effetti sono evidenti in particolare nella parte nord-orientale, la più recente orogenesi alpina (250-50 M.a.) ha invece interessato la Sardegna solo marginalmente (Carmignani et al., 2016).
L’altro evento geologico più rilevante risale al periodo compreso tra 50 e 25 M.a., quando per effetto di una serie di fratture profonde che provocarono le prime separazioni dal settore continentale marginale coincidente con l’attuale Golfo del Leone (Provenza, Francia), il blocco sardo-corso, unitamente alle Isole Baleari, l’attuale Kabilia (Algeria) e parte dell’Arco Calabro interno (Calabria) hanno iniziato a distanziarsi dal continente europeo (Mansion et al., 2007). Dopo la traslazione è intervenuta una rotazione antioraria che si è completata in tempi relativamente recenti (tra 16 e 12 M.a.), determinando l’attuale posizione delle isole di Sardegna e Corsica (Carmignani et al., 2016).
Nelle ultime fasi di traslazione-rotazione del blocco sardo-corso si è formata la « Fossa Sarda », elemento strutturale allungato in direzione Nord-Sud che caratterizza la fascia centro-occidentale della Sardegna. La Fossa Sarda, corrisponde ad un bacino di sedimentazione formatosi per una marcata attività tettonica di tipo distensivo (connessa alla traslazione del blocco) che ha favorito un’intensa attività vulcanica testimoniata dalla presenza di materiali vulcanici e vulcanogenici, intercalati nelle rocce sedimentarie prevalentemente marine. Le rocce sedimentarie deposte in questa fossa sono rappresentate da argille, sabbie, marne e calcari, frequentemente associate a rocce di origine vulcanica quali colate laviche e prodotti piroclastici che affiorano in ampie aree del settore centro-occidentale della Sardegna. Connessa alla più recente tettonica distensiva del Plio-Quaternario è l’apertura di una nuova fossa tettonica, nota con il nome di Graben del Campidano, in parziale sovrapposizione con la precedente Fossa Sarda tra il Golfo di Cagliari e il Golfo di Oristano. L’aspetto attuale della Sardegna deriva dall’evoluzione geologica nel corso delle ere e soprattutto dagli eventi riconducibili alla storia geologica recentissima legata al Pleistocene (ultimi 1,7 M.a.), dominata dalla dinamica esogena causata da processi principalmente fluviali ed eolici e inoltre, influenzata e modificata dall’intensa attività antropica (Carmignani et al., 2016).
Gli eventi ai quali si può ricondurre l’attuale composizione floristica e faunistica della Sardegna sono fondamentalmente la crisi di salinità del Messiniano (Miocene) caratterizzata da variazioni climatiche e tettoniche di grande rilievo con conseguente impatto su flora e fauna, le oscillazioni del livello del mare dovute all’alternarsi di ripetuti periodi glaciali e interglaciali che hanno più volte separato e connesso l’Isola con la Corsica e con il continente e, l’arrivo dell’uomo.
La Sardegna non possiede montagne molto elevate, le cime più alte si trovano sul Massiccio del Gennargentu (Punta la Marmora, 1.834 m s.l.m.), Supramonte (Monte Corrasi, 1.463 m s.l.m.), Monte Limbara (Punta Balistreri, 1.362 m s.l.m.) e Monte Linas (Punta Perda de Sa Mesa, 1.234 m s.l.m.). In generale, le aree montuose con quote superiori ai 600 metri rappresentano il 13,6% dell’Isola e sono prevalentemente costituite da colline ed altipiani rocciosi. Le pianure, tra cui quella del Campidano (che separa il Sulcis-Iglesiente dai rilievi della Sardegna centro-meridionale), la piana della Nurra (nella Sardegna nord-occidentale, tra le città di Sassari, Alghero e Porto Torres) e la piana del Cixerri (che divide il Sulcis dall’Iglesiente e rappresenta un prolungamento verso ovest di quella del Campidano) occupano circa il 18% dell’Isola (Bacchetta et al., 2009).
La rete idrografica rispecchia tale geomorfologia. Il Tirso, il corso d’acqua più lungo dell’Isola (130,2 km), nasce dall’altopiano di Buddusò e sfocia con un delta nel Golfo di Oristano, dividendo, secondo una direzione N-SW, il nord dal centro e sud Sardegna. Il Flumendosa, secondo corso d’acqua per lunghezza (125 km), nasce dai versanti orientali del Gennargentu e sfocia sulla costa sud-orientale, dividendo prima il Massiccio del Gennargentu dai tacchi calcarei della Barbagia e poi, in direzione NW-SE, la stessa Barbagia e l’Ogliastra dai monti del Sarrabus. Il terzo corso d’acqua per lunghezza, il Flumini Mannu di Samassi (97,3 km), nasce dalle pendici del Monte Linas, ripercorre la piana del Campidano di Cagliari in direzione NW-SE, fino a sfociare nel Golfo di Cagliari. Altri corsi d’acqua degni di menzione sono il Coghinas, il Cedrino, il Temo (unico fiume parzialmente navigabile della Sardegna) e il Cixerri (Bacchetta et al., 2009).
Una grande diversità geomorfologica è altresì rilevabile lungo i circa 1900 km di costa. Laddove i venti sono più intensi e l’apporto di materiale sufficiente (soprattutto nella parte occidentale dell’Isola), si alternano estese dune eoliche alle coste alte a falesia. Nelle coste rocciose di origine granitica, profonde valli incise durante le glaciazioni quaternarie e successivamente sommerse hanno dato luogo agli articolati sistemi di insenature a rias che caratterizzano in particolar modo le aree nord-occidentali e sud-orientali della Sardegna. Nei principali golfi, ove i profili di spiaggia sono meno acclivi, un sistema di lunghe spiagge sabbiose si instaura in prospicienza di importanti sistemi di stagni e lagune salmastre, quali quelli del Golfo di Cagliari (Santa Gilla e Molentargius), Oristano (San Giovanni, Marceddì, S’Ena Arrubia, Santa Giusta, Mistras e Cabras) e dell’Asinara (Platamona, Casaraccio e Pilo).
Correlata alla morfologia costiera dell’Isola, altra caratteristica che contraddistingue la Sardegna dagli altri contesti insulari presenti nel Mediterraneo è la presenza, attorno alle sue coste, di quattro arcipelaghi per un totale di oltre 200 piccole isole sulle quali sono presenti sia specie animali che vegetali. Questo numero è unico nel Tirreno e rappresenta circa il 37% delle piccole isole del Mediterraneo occidentale, con valori comparabili solo a quelli delle coste croate e greche (Fois et al., 2016).
La Sardegna presenta un clima di tipo bistagionale, con una stagione temperata ed umida che va dai mesi autunnali a quelli primaverili ed una stagione caldo-arida che si estende dalla tarda primavera fino a tutto il periodo estivo. La posizione geografica e l’insularità sono i fattori generali che caratterizzano tale clima, mitigando le escursioni termiche giornaliere e annue. Le zone che presentano le maggiori escursioni termiche annuali sono localizzate nei sistemi montuosi interni, nella parte centrale della piana del Campidano e in quella di Ottana. In queste zone si registrano escursioni termiche diurne anche di 18-20°C, mentre nelle aree costiere, grazie all’azione mitigatrice del mare, esse sono molto più contenute.
Per quanto concerne le temperature minime, nelle zone più elevate si possono registrare valori negativi per più giorni l’anno, anche durante le ore diurne, mentre nelle aree collinari e costiere le temperature solo eccezionalmente scendono sotto lo zero, e di norma per periodi molto limitati. Relativamente alle temperature massime assolute, i valori più elevati (oltre 40°C) si registrano nelle zone costiere meridionali e nelle pianure interne. Oltre i 1.000 metri di quota, si osservano rilevanti variazioni sia nei dati delle temperature che in quelli delle precipitazioni. Per quanto riguarda le precipitazioni, si ha in generale una maggiore abbondanza sul versante occidentale dell’Isola rispetto a quello orientale, ed un loro graduale incremento, a parità di altitudine, procedendo verso nord. Le precipitazioni massime si verificano nei mesi di novembre e dicembre con un successivo picco, a seconda delle aree e dei periodi considerati, tra febbraio e marzo. Le precipitazioni minime annuali si registrano generalmente nel mese di luglio, che risulta essere anche il mese più caldo. Il periodo di aridità estiva è mediamente di tre mesi e in numerose aree costiere, soprattutto nella Sardegna meridionale, supera anche i quattro mesi. Gli eventi di tipo alluvionale si verificano solitamente nella prima parte dell’autunno e più raramente in primavera. In maniera improvvisa e in un arco temporale molto breve si passa, infatti, dalla fase di aridità prolungata ad un periodo di piogge consistenti e concentrate in un breve lasso temporale (talvolta limitato a poche ore). Tutto ciò contribuisce sovente al verificarsi di fenomeni alluvionali anche di dimensioni rilevanti (Bacchetta et al., 2009).
Dal punto di vista bioclimatico, la Sardegna è principalmente caratterizzata dal bioclima Mediterraneo Pluvistagionale Oceanico (MPO). Nell’Isola si distinguono tre termotipi principali: il Termomediterraneo, con l’orizzonte superiore (Tmes), il Mesomediterraneo suddiviso in orizzonte inferiore (Mmei) e superiore (Mmes) ed il Supramediterraneo inferiore (Smei). Sono inoltre presenti il bioclima Mediterraneo xerico oceanico con orizzonte Termomediterraneo inferiore (Tmei), in particolare per alcune aree costiere del Sulcis e quello Temperato in variante submediterranea sui rilievi del Gennargentu e in limitati settori orientali della catena del Marghine-Goceano. Tenendo conto delle precipitazioni e degli indici ombrotermici derivati, nell’Isola si distinguono l’ombrotipo secco, caratterizzato sia dall’orizzonte inferiore (sei) che da quello superiore (ses), il subumido inferiore (sui) e superiore (sus) e infine l’umido inferiore (hui) (Rivas-Martínez, 2007; Bacchetta et al., 2009).
1.2. Contesto ecologico e patrimonio naturale
1.2.1 Ambiente terrestre
1.2.1.1 Flora
La check-list della Flora Vascolare Italiana (Conti et al., 2005, 2007) attribuisce alla Sardegna una componente floristica composta da 2.494 taxa, di cui 347 endemiche (Bacchetta et al., 2005). La flora vascolare esclusiva della Sardegna consiste di 186 taxa (Fenu et al., 2015b), di cui 163 specie, 16 sottospecie, 4 varietà e 3 ibridi, riconducibili a 37 famiglie e 72 generi. L’elemento corologico dominante è quello circummediterraneo (29%), seguito dall’euroasiatico (17%) e dall’eurimediterraneo (16%). La Lista Rossa regionale delle piante d’Italia (Conti et al., 1997) riporta 291 entità della flora sarda alle quali sono state assegnate categorie IUCN: 5 EW (Estinto in Natura), 39 CR (Gravemente Minacciate), 41 EN (Minacciate), 69 VU (Vulnerabili), 119 LC (Non Minacciate), 17 DD (Mancanza di Dati) e 1 NE (Non Valutata); attualmente non esiste un libro rosso e un catalogo aggiornato con le valutazioni IUCN relative alla flora sarda.
La provincia biogeografica Sardo-Corsa presenta un elevato contingente di entità endemiche esclusive presenti nelle due isole, tra le quali i due generi monotipici Morisia e Nananthea. Inoltre, la presenza di un contingente di specie differenziatesi in epoche remote, quali Centaurea horrida, Bellium crassifolium ed Castroviejoa montelinasana, risulta essere un’altra caratteristica importante della flora sarda. In relazione ai piani bioclimatici, alla morfologia e alle diverse litologie, in Sardegna si possono distinguere diverse tipologie di paesaggio vegetale. In base alla presenza di specie endemiche in particolari unità geomorfologiche, sono stati descritti nell’isola 6 settori e 22 sottosettori biogeografici (Fenu et al., 2014).
Il Settore Gennargenteo è formato da massicci allineati in senso meridiano in cui si trova il gruppo orografico più ampio e rilevante della Sardegna. Nelle aree più elevate di questo massiccio montuoso si insediano microboschi dominati da Juniperus nana e garighe di quota dominate da arbusti spinosi emisferici in cui si trovano endemismi come Genista pichisermolliana, Thymus herba-barona, Astragalus genargenteus, Ruta lamarmorae e Lamyropsis microcephala. Le aree montane e submontane sono caratterizzate dalla presenza di boschi a dominanza di querce caducifoglie (Quercus congesta, Q. ichnusae e Q. dalechampii). A quote più basse o sui versanti meridionali in posizione edafoxerofila, sono presenti leccete pure o con Acer monspessulanum subsp. monspessulanum, talvolta frammiste a Fraxinus ornus subsp. ornus e Ostrya carpinifolia (Bacchetta et al., 2009).
Il settore Goceano-Logudorese è anch’esso prevalentemente montuoso ma caratterizzato da cime meno elevate, la più alta (Punta Balestrieri) raggiunge i 1.362 m s.l.m. Le sugherete rappresentano le formazioni vegetali più caratteristiche di questa regione e la loro diffusione è stata fortemente favorita dall’uomo per effetto del taglio selettivo e dell’incendio. Lo strato arbustivo di questi boschi è caratterizzato da Cytisus laniger, Cytisus villosus, Arbutus unedo, Erica arborea e altre specie calcifughe quali Myrtus communis e Lavandula stoechas. Lungo i versanti e nelle aree con rocce affioranti prevalgono invece le leccete. Man mano che si sale di quota, le diverse tipologie di leccete si arricchiscono di elementi mesofili, quali Ilex aquifolium, Sanicula europaea e Polystichum setiferum. Soltanto alle quote più elevate e in situazioni di colluvio si rinvengono boschi di querce caducifoglie di estensione molto limitata e dominati da Quercus ichnusae e Q. dalechampii.
I settori calcarei mesozoici del Supramonte sono caratterizzati da leccete pure o con orniello alle quote più basse e da leccete con acero di Montpellier a quelle più elevate. In posizione adafoxerofila si rinvengono microboschi di Juniperus turbinata, mentre in posizione mesofila sui versanti esposti a mare dominano non di rado i boschi di O. carpinifolia specie nelle porzioni più meridionali del Golfo di Orosei. Nei fondi delle codule e delle forre si rinvengono boschi ripariali ad Alnus glutinosa e boschi di Taxus baccata con carattere relittuale. Le formazioni casmo-comofitiche delle pareti rocciose presentano un elevato tasso di endemismi caratteristici di questo settore, tra cui: Astragalus gennarii, Centaurea filiformis, Lactuca longidentata, Ptychotis sardoa, Aquilegia nuragica e A. cremnophila.
Sempre di natura calcarea, ma caratterizzato da conformazioni ad altipiano dette a “Tacco” o “Tonneri”, il settore Barbaricino, a sud del massiccio del Gennargentu, è caratterizzato dalle formazioni a leccio, secondariamente da boschi di querce caducifoglie e sughera e da caratteristiche formazioni a carpino nero (Ostrya carpinifolia). La componente endemica consta di 116 taxa, perlopiù condivisa con i settori Gennargenteo e Supramontano, ma anche da alcuni taxa esclusivi quali Anchusa capellii, Senecio morisii e Pinguicula sehuensis.
Il settore Sulcitano-Iglesiente, situato nella Sardegna sud-occidentale, è molto variegato sia dal punto di vista litologico che da quello morfologico. Nelle aree montuose e collinari dominano le formazioni a leccio che si rinvengono su tutti i substrati, dal livello del mare sino alle aree cacuminali e che, nelle zone più elevate, si arricchiscono di Ilex aquifolium e Acer monspessulanum. Caratteristiche sono poi le aree dismesse minerarie che determinano habitat calaminari altamente selettivi in cui la bassa pressione di competizione ha favorito i processi di speciazione e la presenza di taxa endemici quali Echium anchusoides, Genista sulcitana, Iberis integerrima, Limonium merxmuelleri, Linum muelleri, Ptilostemon casabonae e Santolina insularis (Bacchetta et al., 2007).
Il settore Campidanese-Turritano è generalmente caratterizzato da una vegetazione termoxerofila ad olivastro e filliree, da ginepreti edafoxerofili a Juniperus oxycedrus e, solo secondariamente, da boschi di leccio e formazioni edafoigrofile costituite da oleandreti e, in aree limitate, da ontaneti e saliceti a Salix purpurea. In prossimità delle coste si sviluppa la vegetazione a Juniperus turbinata con Euphorbia dendroides, Pistacia lentiscus e Phillyrea angustifolia. Sui substrati calcarei dominano invece i ginepreti arricchiti dalla presenza della palma nana (Chamaerops humilis).
Le aree costiere e micro-insulari sono anch’esse molto variegate dal punto di vista geomorfologico e pertanto ricche di taxa endemici (Fois et al., 2016). Nelle falesie (prevalenti nei settori Sulcitano-Iglesiente e Campidanese-Turritano) dominano le formazioni vegetali riferibili alla classe Crithmo maritimi-Staticetea, presente con numerose associazioni caratterizzate da entità endemiche del genere Limonium (con circa 40 specie endemiche), riferibili all’alleanza endemica Erodio corsici-Limonion articulati. Le garighe camefitiche primarie vengono invece riferite all’alleanza Euphorbion pithyusae della classe Helichryso-Crucianelletea maritimae. Le più diffuse lungo le coste settentrionali dell’Isola sono riferibili all’associazione Euphorbio pithyusae-Helichrysetum tyrrhenici (Bacchetta et al., 2009; Biondi et al., 2014).
I microboschi psammofili sono principalmente caratterizzati dalla presenza di Juniperus macrocarpa e riferiti all’associazione Pistacio lentisci-Juniperetum macrocarpae e da ginepreti a Juniperus turbinata, costituenti solitamente microboschi termomediterranei edafo-xerofili e generalmente riferiti a quattro associazioni: Oleo-Juniperetum turbinatae, Erico-Juniperetum turbinatae, Chamaeropo-Juniperetum turbinatae ed Euphorbio characiae-Juniperetum turbinatae. I boschi a quercia della Palestina (Quercus calliprinos) sono limitati quasi esclusivamente a sistemi dunali eolici e ai campi dunali del settore Sulcitano-Iglesiente (Bacchetta et al., 2009) così pure le pinete autoctone a Pinus pinea, presenti in forma naturale solo presso Portixeddu di Buggerru nell’Iglesiente-Fluminese.
Inquadramento biogeografico della Sardegna e la sua flora esclusiva
La posizione isolata al centro di una delle aree più biodiverse a livello globale, l’elevata diversità ambientale e il buono stato di conservazione degli habitat naturali, sono solo parte dei fattori che hanno determinato le peculiarità della flora sarda. Allo stato attuale delle conoscenze, circa l’8% dei taxa vegetali presenti (186 taxa; Fenu et al., 2015b) è infatti esclusivo dell’Isola. Tale proporzione è comunque destinata ad aumentare per le continue scoperte a livello tassonomico e distributivo, soprattutto nelle aree montuose calcaree e microinsulari, dove la concentrazione dei taxa esclusivi è già maggiore del 15% (Fenu et al., 2010). Sebbene solo alcuni di questi taxa siano legalmente protetti da direttive a livello comunitario, per un criterio di responsabilità regionale (Bacchetta et al., 2012), tutti i taxa esclusivi di un territorio amministrativo regionale, dovrebbero essere oggetto di attenzione dal punto di vista conservazionistico.
Recentemente, un lavoro di aggiornamento tassonomico e digitalizzazione dei dati distributivi di questo interessante gruppo di taxa, ha permesso di implementare le conoscenze biogeografiche dell’Isola. In particolare, il precedente inquadramento biogeografico che inseriva la Sardegna all’interno della Regione Mediterranea e Provincia Sardo-Corsa è stato implementato sino alla definizione in dettaglio di 6 settori e 22 sottosettori biogeografici, all’interno della Sottoprovincia Sarda (Fig.1).
Come « isole nell’Isola », ciascun sottosettore identificato è stato caratterizzato dalla presenza di un minimo di 29 (Sottosettore Sinisico) ad un massimo di 98 taxa endemici (Sottosettore Barbaricino). Un particolare interesse ricopre anche il Sottosettore Tavolarino (rappresentato, appunto, dall’Isola di Tavolara), il quale annovera la più alta concentrazione di endemiti vascolari con 44 taxa in appena 9 km2. Ad un livello superiore, almeno due (nel caso del Settore Barbaricino) sino ad un massimo di 33 taxa (Settore Sulcitano-Iglesiente) sono esclusivi di ciascun Settore Biogeografico. Questi dati non tengono comunque conto delle più recenti conoscenze relative, ad esempio, alla scoperta dell’unica specie del genere Pinguicula in Sardegna (Pinguicula sehuensis), descritta come esclusiva dei territori rupicoli calcarei del Settore Barbaricino o del Senecio morisii, sempre esclusivo del Settore Barbaricino, ma legato agli ambienti ripariali.
Tali risultati, ottenuti raggruppando piccole unità geomorfologiche in base alla presenza/assenza degli elementi vegetali in esame, hanno confermato l’importanza dei fattori abiotici nel determinare l’attuale distribuzione delle specie. Una spiccata caratterizzazione di questo tipo è infatti legata ad una elevata complessità geomorfologica che determina un forte isolamento di ciascun frammento omogeneo di territorio. A livello più applicativo, i Settori e Sottosettori delineati rappresentano uno strumento per la pianificazione della conservazione alla scala regionale e locale. Ad esempio, le peculiarità floristico/geomorfologiche di ciascuna unità biogeografica potranno essere considerate al momento di pianificare interventi atti al rinforzo popolazionale di specie di particolare rilevanza conservazionistica o al recupero di alcuni habitat particolarmente frammentati o degradati.
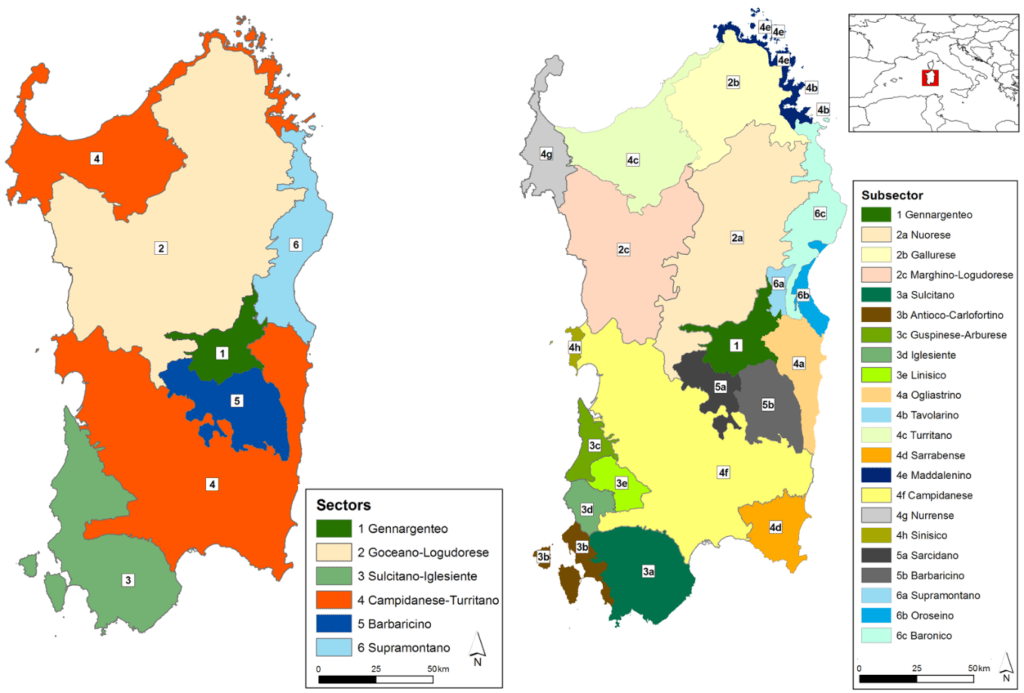
Figura 1. Suddivisione della Sardegna a livello di settore e sottosettore biogeografico (Fenu et al., 2014).
Bibliografia
Bacchetta G., Farris E. & Pontecorvo C., 2012. A new method to set conservation priorities in biodiversity hotspots. Plant Biosystems, 146, 638-648.
Fenu G., Fois M., Cogoni D., Porceddu M., Pinna M.S., Cuena L.A., Nebot A., Sulis E., Picciau R., Santo A., Murru V., Orru` M. & Bacchetta G., 2015b. The Aichi Biodiversity Target 12 at regional level: an achievable goal? Biodiversity, 16, 120-135.
Fenu G., Mattana E., Congiu A. & Bacchetta G., 2010. The endemic vascular flora of Supramontes: a priority plant conservation area in Sardinia. Candollea, 65, 347-358.
Mauro Fois
1.2.1.2. Fauna
La posizione geografica della Sardegna, nonché gli eventi geologici, climatici e storici che l’hanno caratterizzata, hanno fatto sì che l’Isola ospiti una fauna varia e, soprattutto, molto ricca di specie endemiche e d’interesse biogeografico. La checklist della fauna italiana riporta per la Sardegna ben 697 specie endemiche, pari al 6,38% delle 10.915 accreditate per l’isola; a queste vanno poi ad aggiungersi quelle entità endemiche condivise con la vicina Corsica (Minelli & Stoch, 2005), nonché le specie di recente descrizione (Taiti & Argano, 2009, 2011) non ancora annoverate nella checklist al momento della sua compilazione. È facilmente intuibile che il tasso degli endemiti possa essere rilevante in ambiti insulari, in particolare in quei gruppi animali caratterizzati da scarsa vagilità. È questo il caso della Sardegna dove il numero delle specie endemiche è particolarmente alto soprattutto per quanto concerne gli invertebrati ma tuttavia pregevole anche per i vertebrati, fra i quali si annoverano, come sopra accennato, specie esclusive della Sardegna oltre ad altre condivise con la Corsica. Le specie endemiche sono particolarmente numerose tra quegli organismi che conducono vita sotterranea; la Sardegna si caratterizza infatti per la presenza di estesi complessi carsici costituiti da doline, inghiottitoi, grotte e habitat ipogei dove gli artropodi endemici sono straordinariamente numerosi. L’Isola è inoltre circondata da un gran numero di isole satelliti che ospitano, a seconda della loro complessità, una fauna ricca comprensiva anch’essa di specie endemiche. La peculiarità della fauna sarda è da riferirsi alla presenza di elementi molto antichi, paleomediterranei e paleotirrenici, di origine pre-miocenica, ovvero relativi a un periodo precedente il distacco della Sardegna dal continente europeo.
I mammiferi attuali presenti sull’Isola, a differenza delle ricche faune che si sono succedute naturalmente durante il Terziario e il Quaternario, sono da riferirsi ad importazione recente e non presentano entità esclusive se non a livello sottospecifico, fatta eccezione per l’orecchione sardo (Plecotus sardus), descritto di recente come l’unico mammifero endemico della Sardegna, nonché unico pipistrello endemico italiano (Mucedda et al., 2002). A partire da epoche pre-neolitiche l’uomo ha cacciato le specie endemiche dell’Isola fino ad estinguerle, introducendone successivamente altre quali la capra, la pecora, il maiale, il bue, il cavallo, l’asino ed altre ancora. Fra i carnivori attualmente presenti sull’Isola si ricordano la martora (Martes martes) verosimilmente introdotta dai Romani o in un periodo di poco precedente; la donnola (Mustela nivalis subsp. boccamela) che sull’Isola è caratterizzata da taglia maggiore rispetto alle popolazioni continentali italiane; il gatto selvatico africano (Felis silvestris subsp. lybica), ritenuto all’origine di tutte le forme domestiche; la volpe sarda (Vulpes vulpes subsp. ichnusae), di cui lo status sottospecifico è tuttora dibattuto e che presenta dimensioni inferiori rispetto alle popolazioni continentali; la foca monaca (Manachus monachus) segnalata ormai solo occasionalmente lungo le coste settentrionali e orientali dell’Isola.
Anche fra gli ungulati, seppur non vi siano specie esclusive della Sardegna, si trovano: il muflone (Ovis orientalis subsp. musimon), introdotto in epoca Neolitica; il cervo sardo (Cervus elaphus subsp. corsicanus), della cui presenza in Sardegna non esistono tracce antecedenti al Neolitico; il cinghiale (Sus scrofa subsp. meridionalis) introdotto nel Neolitico antico e il daino (Dama dama), di recente reintroduzione in quanto la precedente popolazione, seppur numerosa, fu sterminata nella seconda metà del secolo scorso. Fra i mammiferi di minori dimensioni, la Sardegna ospita il riccio (Erinaceus europaeus subsp. italicus); il mustiolo (Suncus etruscus) e la crocidura mediterranea (Crocidura pachyura). La lepre sarda (Lepus capensis subsp. mediterraneus), è caratterizzata da dimensioni inferiori rispetto alla lepre continentale, mentre il coniglio selvatico (Oryctolagus cuniculus) è stato introdotto dai Fenici e dai Romani nel Mediterraneo centrale. Per i roditori troviamo una sottospecie di ghiro (Glis glis subsp. melonii) presente esclusivamente in Sardegna e Corsica; il topo quercino sardo (Eliomys quercinus subsp. sardus); il topo selvatico (Apodemus sylvaticus subsp. dichrurus) dell’Europa mediterranea; il topolino domestico (Mus musculus); il ratto delle chiaviche (Rattus norvegicus) e il ratto nero (Rattus rattus); da ricordare inoltre la presenza della nutria (Myocastor coypus), introdotta di recente anche in Sardegna. Grande importanza rivestono invece i chirotteri che sull’Isola sono presenti con ben 21 specie. Fra queste sono particolarmente importanti le popolazioni troglofile fra le quali troviamo, oltre al raro e già citato orecchione sardo, imponenti colonie di miniotteri, di rinolofo di Mehely (Rhinolophus mehelyi) segnalato in Italia solo in Sardegna e in Sicilia, e di vespertilio maghrebino (Myotis punicus), la cui presenza in Europa è attestata esclusivamente dalle popolazioni sarde e da quelle corse.
La grande ricchezza di habitat di cui la Sardegna dispone ha anche favorito la presenza di un’avifauna, sia stanziale sia migratrice, di grande rilievo. Le specie di uccelli da elencare per l’Isola sono così numerose che in questa sede verrà fatto esclusivamente cenno ad alcune entità endemiche e particolarmente rappresentative dei diversi habitat sardi, rimandando per tutte le altre alle varie pubblicazioni che trattano questo gruppo animale. Fra i rapaci, che fino a epoche recenti annoveravano per l’Isola l’avvoltoio monaco e il gipeto, si ricordano l’aquila reale (Aquila chrysaetos), l’astore sardo (Accipiter gentilis subsp. arrigonii), lo sparviere sardo (Accipiter nisus subsp. wolterstorffi), la poiana della Sardegna (Buteo buteo subsp. arrigonii), il grifone (Gyps fulvus), il barbagianni sardo (Tyto alba subsp. ernesti) e il falco della regina (Falco eleonorae). Fra i passeriformi, la calandrella (Calandrella brachydactyla), lo scricciolo sardo (Troglodytes troglodytes subsp. koenigi), la magnanina sarda (Sylvia sarda), la sterpazzolina (Sylvia subalpina), il pigliamosche tirrenico (Muscicapa striata subsp. tyrrhenica), la cinciallegra sarda (Parus major subsp. ecki), la cincia mora sarda (Parus ater subsp. sardus), il fringuello sardo (Fringilla coelebs subsp. sarda), il verdone (Carduelis chloris subsp. madaraszi), il venturone corso (Carduelis citrinella subsp. corsicana), il cardellino (Carduelis carduelis subsp. tschusii), la passera sarda (Passer hispaniolensis), la ghiandaia sarda (Garrulus glandarius subsp. ichnusae), il corvo imperiale sardo (Corvus corax subsp. sardus), l’averla baia (Lanius senator subsp. badius). Tra i non-passeriformi si ricordano il gruccione (Merops apiaster), il picchio rosso maggiore (Dendrocopos major subsp. harterti), la pernice sarda (Alectoris barbara) e, tra le specie di prateria, l’occhione (Burhinus oedicnemus) e la gallina prataiola (Tetrax tetrax). Di quest’ultima, la popolazione sarda è l’unica ancora presente in Italia. Fra gli uccelli che frequentemente si possono osservare nelle importanti zone umide dell’Isola troviamo l’airone rosso (Ardea purpurea), l’airone bianco maggiore (Casmerodius albus), il mignattaio (Plegadis falcinellus), la moretta tabaccata (Aythya nyroca) e l’anatra marmorizzata (Marmaronetta angustirostris), numerose specie di limicoli come l’avocetta (Recurvirostra avosetta), il corriere grosso (Charadrius hiaticulas) che sverna in Sardegna e il fratino (Charadrius alexandrinus); fra i rallidi si ricorda il pollo sultano (Porphyrio porphyrio), stanziale in Sardegna e reintrodotto relativamente di recente in Sicilia. I fenicotteri, tradizionalmente considerati un simbolo degli stagni e delle lagune costiere della Sardegna, dal 1993 hanno ripreso con continuità la nidificazione sull’Isola. Fra i principali uccelli marini si ricordano il gabbiano corso (Ichthyaetus audouinii), il marangone dal ciuffo (Phalacrocorax aristotelis subsp. desmarestii), l’uccello delle tempeste (Hydrobates pelagicus), la berta maggiore (Calonectris diomedea) e la berta minore (Puffinus yelkouan); relativamente a quest’ultima specie è importante segnalare che oltre il 50% della popolazione mondiale nidifica sull’Isola di Tavolara.
Sempre tra i vertebrati, la Sardegna è l’isola del Mediterraneo che vanta il numero maggiore di specie endemiche di anfibi e rettili. Per quanto concerne i primi, di grande rilievo sono le popolazioni troglofile di geotritoni appartenenti al genere Speleomantes, unico rappresentante della famiglia Plethodontidae in Europa, che è rappresentata da ben 5 specie esclusive: Speleomantes flavus, S. genei, S. imperialis, S. sarrabusensis e S. supramontis, distribuite in 5 distinte aree dell’Isola. Endemico è anche il tritone sardo (Euproctus platycephalus) che vive in torrenti e pozze delle aree collinari e montane; la raganella tirrenica (Hyla sarda) e il discoglosso sardo (Discoglossus sardus), ambedue entità tirreniche presenti anche in Corsica e su alcune isole dell’Arcipelago Toscano; il discoglosso sardo è presente anche sulle Isole Hyères (Francia). In Sardegna vivono anche il rospo smeraldino (Bufotes balearicus) e rane verdi appartenenti al genere Pelophylax spp. I rettili presenti sul territorio sardo contano 22 specie, tra cui: le tartarughe marine, che comprendono Caretta caretta che nidifica lungo le coste sarde meridionali, Chelonia mydas e Dermochelys coriacea; le testuggini d’acqua dolce Emys orbicularis, specie autoctona, e Trachemys scripta, specie aliena e invasiva recentemente e volontariamente introdotta dall’uomo sull’Isola. In Sardegna sono anche presenti ben tre specie di testuggini terrestri, la testuggine di Hermann (Testudo hermanni), la testuggine moresca (T. graeca) e la testuggine marginata (T. marginata); tre specie di lucertola endemiche della Provincia biogeografica Sardo-Corsa: l’algiroide nano (Algyroides fitzingeri), la lucertola di Bedriaga (Archaeolacerta bedriagae) e la lucertola tirrenica (Podarcis tiliguerta) che conta anche la sottospecie sarda microinsulare Podarcis tiliguerta ranzii dell’Isolotto Molarotto, nonché la lucertola campestre (Podarcis siculus) presente anche in Sicilia e in Italia continentale. Tra i gechi, particolare rilevo va dato al tarantolino (Euleptes europaea), specie peculiare dell’area tirrenica caratterizzato da un’estesa distribuzione micro-insulare ; al quale si aggiungono l’emidattilo (Hemidactylus turcicus) e la tarantola (Tarentola mauritanica), ampiamente distribuiti nell’area mediterranea. In Sardegna si trovano anche la luscengola (Chalcides chalcides) e il Chalcides ocellatus subsp. tiligugu, sottospecie di gongilo appartenente al clade tunisino, presente in Italia esclusivamente in Sardegna, in Sicilia e nel Bosco di Portici (Napoli), dove è stato introdotto nel Settecento. Fra i serpenti si ricordano la natrice viperina (Natrix maura), la natrice del Cetti (Natrix natrix subsp. cetti), sottospecie sarda della natrice dal collare, il biacco (Hierophis viridiflavus), il colubro ferro di cavallo (Hemorrhois hippocrepis) e il saettone (Zamenis sp.) del quale, per l’Isola, sono stati riportati solo avvistamenti sporadici.
Per quanto riguarda la fauna ittica autoctona dulcacquicola si ricordano l’alosa (Alosa fallax) del Flumendosa e del lago Omodeo; l’anguilla (Anguilla anguilla); la trota mediterranea (Salmo cettii) che è considerata una “evolutionarily significant unit (ESU)” ovvero una specie della quale bisogna tenere di conto quando si operano azioni di conservazione; la lampreda di mare (Petromyzon marinus) che si riproduce nelle acque interne; il latterino (Atherina boyeri) tipico delle aree costiere, il nono (Aphanius fasciatus); lo spinarello (Gasterosteus aculeatus) che si può osservare sia in acque salmastre sia in quelle dolci; la cagnetta (Salaria fluviatilis); il cefalo calamita (Liza ramada) e il cefalo musino (Liza saliens), presenti in ambienti estuariali.
Le specie di invertebrati esclusive della Sardegna sono molto numerose, prevalentemente cavernicole e appartenenti a vari gruppi sistematici paleotirrenici fra i quali troviamo anche generi affini a elementi iberolevantini, provenzali e tirrenici. L’Isola inoltre ospita specie endemiche di anellidi, quali l’oligochete Prosellodrillus festai, di molluschi gasteropodi quali Sardohoratia islamioides, S. sulcata e Sardopaladilhia plagigeyerica di acque sorgive, e due nuove specie di Hygromiidae, Xerosecta sandaliotica e X. brachyflagellata, descritte di recente (De Mattia & Mascia, 2014). Fra gli innumerevoli isopodi terrestri, di cui il 35% delle specie è endemico, si ricordano numerosi Trichoniscidae quali Utopioniscus kuehni, Alpioniscus fragilis, A. thanit, Catalauniscus puddui, C. hirundinella, le specie dei generi Oritoniscus e Nesiotoniscus, quelle del genere Scotoniscus, S. baccettii e S. janas, rispettivamente esclusivi di una grotta dell’Isola di Tavolara e di una dell’Iglesiente, e le specie cavernicole o endogee del genere Alloschizidium (Armadillidiidae). Fra gli isopodi stigobi vanno menzionate le specie Stenasellus nuragicus e S. assorgiai e fra gli anfipodi molte specie del genere Bogidiella, Tyrrhenogammarus sardous, Ingolfiella (Tyrrhenidiella) cottarellii. Fra i Chilopodi si ricordano Haplophilus sardous, Lithobius turritanus e L. sardous; per i diplopodi il genere Sardopus, Glomeris lunatosignata e diverse specie del genere Devillea. Anche fra gli Aracnidi si annoverano diverse specie endemiche fra le quali spiccano quelle numerose di pseudoscorpioni, di cui la Sardegna è la regione italiana più ricca. Per gli esapodi si ricordano i Collemboli Arrhopalites giovannensis, Hypogastrura gennargentui e Endonura ichnusae, le blatte Ectobius ichnusae e E. sardous; per i Coleotteri il famoso carabide cavernicolo Duvalius sardous, gli Scarabei Chelotrupes matutinalis e C. hiostius, la lucciola di Sardegna (Lampyris sardiniae), Carabus genei, Sardaphaenops supramontanus presente solamente in alcune grotte del Sopramonte e, fra gli Idrofilidi, Laccobius sinuatus subsp. binaghii, fra i Ditiscidi Hydroporus sardomontanus endemico delle aree montane della Sardegna, degne di nota anche le 11 specie sarde di Stafilinidi del genere Trogasteropsis appena descritte da Poggi, Fancello, Leo (2021) ; fra gli Imenotteri si ricorda la sottospecie di bombo Bombus terrestris subsp. sassaricus, mentre per gli Ortotteri, che sull’Isola sono presenti con ben 13 taxa endemici, il panfago sardo (Pamphagus sardeus), una grossa cavalletta. Per le farfalle è particolarmente degna di menzione Papilio hospiton, un endemismo sardo-corso strettamente legato alla presenza della Ferula communis della quale la larva di questa farfalla si nutre; Argynnis elisa è un endemismo sardo-corso che vive nelle aree montane settentrionali e centrali dell’Isola, il satiro dei nuraghi (Maniola nurag), una specie anch’essa montana ed esclusiva della Sardegna, nonché altre appartenenti a generi diversi quali l’argo corsicano (Plebejus bellieri), l’argo barbaricino (Pseudophilotes barbagiae) e l’argo del Gennargentu (Polyommatus coridon subsp. gennargenti), l’esperide sardo-corsa (Spialia therapne), la cavolaia isolana (Euchloe insularis), la vanessa sarda (Aglais ichnusa) e le zigene (Zygaena orana subsp. sardoa e Z. corsica), nonché molti altri gruppi di insetti, fra quali si ricorda Smicromyrme olienensis Pagliano & Strumia 2019, una nuova specie di Mutillidi di recente descritta e, Plecotteri ed Eterotteri (Dellacasa & Dellacasa, 2008; Grussu, 2001; Lanza et al., 2007; Masseti 2002, 2009a 2009b; Mucedda & Pidinchedda, 2010; Rocchi, 2011; Ruffo & Stoch, 2005; Stoch & Genovesi, 2016; Zanetti et al., 2010).
1.2.2 Ambiente marino
I fondali rocciosi contraddistinguono il tratto costiero della Sardegna e delle isole maggiori, presentando geomorfologie diversificate ed articolate, mentre la restante parte della piattaforma costiera è occupata da fondi mobili. In particolare, la natura dei fondali sardi è caratterizzata da differenti tipi di substrati che variano dalle litologie basaltiche a quelle granitiche, da rocce carbonatiche a sedimenti sabbiosi (Guidetti et al., 2004).
Da tale eterogeneità a livello mineralogico deriva la biodiversità che contraddistingue l’ambiente marino sardo (Guidetti et al., 2004) e che comprende numerosi endemismi Mediterranei.
Nelle zone costiere, procedendo dalla superficie verso il fondo, si trovano nella zona medio-litorale i marciapiedi (o trottoir) a Lythophyllum byssoides e nella parte inferiore del piano mesolitorale Patella ferruginea, specie presente dal Pleistocene in tutto il bacino Mediterraneo (Scotti & Chemello, 2000) ma che è tra i molluschi marini maggiormente a rischio d’estinzione del Mediterraneo (Marra et al., 2016b).
Nella zona di transizione tra i piani meso ed infra-litorale, si possono trovare le biocostruzioni a Vermetidi, della cui realizzazione è responsabile la specie Dendropoma petraeum e, soprattutto nei substrati duri di natura calcarea, il mollusco bivalve Lithophaga lithophaga.
Nelle comunità infralitorali, tra le componenti più importanti vi è Posidonia oceanica, pianta vascolare marina che sulla costa occidentale della Sardegna forma le praterie più estese del Mediterraneo (Bouduresque, 2004). Tali praterie, più comuni su fondi sabbiosi, sono importanti aree di “nursery” e fungono da veri e propri serbatoi di biodiversità, in quanto ospitano popolamenti ittici molto diversificati che comprendono specie appartenenti ai Singnatidi, Labridi (Symphodus spp.) e Sparidi, come Sarpa salpa e Spicara smaris, le quali sono indicate tra le specie più comuni dei posidonieti del bacino Nord-Occidentale Mediterraneo (Harmelin-Vivien, 1983). Inoltre, anche il mollusco bivalve endemico del Mediterraneo Pinna nobilis è solitamente associato alle praterie di posidonia (ANPA, 2001).
Nel piano infralitorale roccioso, oltre che a profondità inferiori, si possono riscontrare gli echinodermi Paracentrotus lividus e Arbacia lixula (Guidetti et al., 2004). Tra i vertebrati, i popolamenti ittici sono particolarmente studiati in ambienti oggetto di tutela e comprendono decine di specie, spesso di elevato valore economico (Di Franco et al., 2009; Marra et al., 2016a). Alcuni dei rappresentanti più caratteristici sono la triglia di scoglio (Mullus surmuletus), la ricciola (Seriola dumerilii), la corvina (Sciaena umbra), molte specie di Sparidi (Dentex dentex, Diplodus spp.) e il barracuda (Sphyraena spp.). Molti pesci Osteitti vivono in associazione ai fondi mobili, come molte specie demersali: la tracina (Trachinus spp.), la triglia di fango (Mullus barbatus), la rana pescatrice (Lophius piscatorius) e diverse specie di gallinelle (Bulgarini et al., 2006).
Nella zona circalitorale le comunità sciafile del coralligeno possono essere molto comuni, nonostante si possano estendere batimetricamente anche all’infralitorale, laddove le condizioni luminose siano ridotte (Ballesteros, 2003). Il coralligeno si distingue per la significativa bio-concrezione e la presenza di alcune specie chiave come le gorgonie (Paramuricea clavata), Eunicella spp. e le popolazioni di Corallium rubrum, più comunemente distribuite tra i 30-200 metri di profondità (Cau et al., 2013).
Tali comunità forniscono complessità strutturale alla numerosa fauna ittica che frequenta tali siti e che può comprendere specie gregarie come Anthias anthias o specie che non ne sono esclusive, quali il sarago (Diplodus sargus), la murena (Muraena helena), la corvina e la cernia bruna (Epinephelus marginatus), contraddistinte anche da taglie elevate (Guidetti et al., 2007).
Per quanto concerne l’ambiente pelagico, nel mare che circonda le coste sarde vivono quattro specie di tartarughe marine, di cui la più abbondante risulta essere la tartaruga marina comune Caretta caretta (Bulgarini et al., 2006).
Assai rilevante è anche la presenza di cetacei, soprattutto nell’area compresa nella porzione di mare denominata « Santuario dei cetacei », dove la stenella (Stenella coeruleoalba) e la balenottera comune (Balaenoptera physalus) sono tra le specie più frequenti. La notevole abbondanza di grandi organismi pelagici nella fauna marina è legata ad una serie di proprietà fisico-oceanografiche, tra cui la presenza di un sistema frontale permanente. Grazie all’elevata produttività primaria derivante dalle zone di upwelling, le acque comprese nel santuario ospitano una cospicua popolazione di Meganyctiphanes norvegica, crostacei eufasiacei appartenenti allo zooplancton e tra i principali componenti del cosiddetto krill, alla base della catena alimentare pelagica. A ciò è dovuta la presenza, nella fauna ittica, di grossi pesci pelagici quali il tonno (Thunnus thynnus), varie specie di squali, il pesce spada (Xiphias gladius), la manta mediterranea (Mobula mobular) e il pesce luna (Mola mola) (ANPA, 2001).
1.3. Occupazione umana e storia ambientale
Le prime testimonianze della presenza umana nell’Isola risalgono al Paleolitico inferiore, un periodo compreso tra i 500.000 e i 100.000 anni fa. Tali testimonianze sono date dal ritrovamento presso Perfugas, in territorio di Sassari, di alcuni rudimentali strumenti litici in selce, mentre è solo intorno ai 20.000 anni fa che vengono fatte risalire le prime tracce dell’uomo moderno (Homo sapiens). Durante questo periodo (mesolitico), la Sardegna era abitata da piccoli gruppi umani che vivevano di caccia e raccolta, sfruttando come luoghi abitativi le grotte e i ripari sotto roccia. Questi gruppi umani non conoscevano ancora l’allevamento e l’agricoltura, tanto meno la ceramica. Le testimonianze dirette di questi gruppi sono date dal ritrovamento di strumenti in ossidiana e selce provenienti da contesti funerari e abitativi in grotta. Le testimonianze più significative provengono dalla Grotta Corbeddu nella vallata di Lanaitto ad Oliena, dalla Grotta Su Coloru di Laerru e dal riparo sotto roccia di Su Carroppu di Sirri (Lugliè, 2009).
In una fase successiva, circa 7.000 anni fa (periodo Neolitico), la Sardegna veniva colonizzata da gruppi umani che provenivano dal continente italiano: si tratta delle prime comunità neolitiche che praticavano l’agricoltura e l’allevamento.
Le recenti indagini archeologiche e le datazioni al carbonio 14 disponibili per i siti del Neolitico antico della Sardegna, collocano alle soglie del VI millennio la presenza stabile delle prime comunità neolitiche nell’Isola (Lugliè, 2009). Si tratta di nuove comunità che non ebbero nulla in comune con il sostrato mesolitico isolano: gli elementi di discontinuità si evidenziano sia nello iato documentato stratigraficamente nei contesti con sequenze mesolitiche e neolitiche che nel cambiamento dei modi di vita e nell’uso ottimale delle risorse e del territorio e, per tale ragione, si è parlato di una vera e propria colonizzazione dell’Isola (Lugliè, 2009). In una prima fase, il Neolitico antico della Sardegna fu caratterizzato da una produzione ceramica con decorazione cardiale che trova confronti con le comunità neolitiche tirreniche e, più in generale, con quelle del Mediterraneo occidentale (Lugliè, 2009; Pessina & Tiné, 2008). I siti archeologici inquadrati alle soglie del VI millennio si concentrano nella Sardegna centro-meridionale, e le aree planiziali costiere vengono preferite dalle prime comunità neolitiche a differenza delle evidenze riferibili al sostrato mesolitico che viene documentato per lo più in contesti di grotta (Lugliè, 2009). I dati sulle piante coltivate in questo periodo sono molto scarsi e gli unici indizi agricoli provengono dalla grotta di Filiestru presso Bonu Ighinu (Mara – Sassari) (Trump, 1983).
Il Neolitico medio si situa cronologicamente tra il V e il IV millennio a.C. La cultura associata alla fase iniziale di questo periodo prende il nome di Cultura di Bonu Ighinu. Le prime attestazioni sicure risalgono agli anni 70 quando si individuarono nella grotta di Sa Ucca de su Tintirriolu nel territorio di Mara materiali ceramici caratteristici che portarono alla definizione di questa cultura (Lorìa & Trump, 1978). Gli elementi distintivi di questa cultura si evidenziano nella produzione ceramica di fattura fine e con decorazioni a motivi incisi e graffiti a cotto. Nessun dato paleoeconomico è disponibile per questa fase. Un orizzonte maturo e terminale del Neolitico medio è stato riconosciuto più tardivamente e prende il nome di Cultura di San Ciriaco di Terralba (Lugliè, 2003). Poco noto per il numero limitato di scavi che l’hanno interessata, questa cultura occupa la seconda metà del V millennio a.C.
Il Neolitico recente si attesta tra il IV e il III millennio a.C. La cultura che si sviluppa in questo periodo è detta Cultura di Ozieri, nome che deriva dalla località di San Michele di Ozieri in cui venne scoperta (Lilliu, 2004). Gli insediamenti abitativi si documentano sia presso cavità naturali che in villaggi all’aperto. L’economia, sulla base dei pochi dati disponibili, sembra basarsi sull’allevamento di bovini, ovicaprini a cui si affiancano le attività di pesca e caccia del cervo e del cinghiale. In Sardegna, i dati disponibili sull’agricoltura preistorica del Neolitico si basano su pochi resti vegetali recuperati durante le operazioni di scavo in grotta in contesti inquadrati tra il Neolitico antico e il Neolitico recente tra gli anni ’60 e ’80. La presenza di resti di cereali e leguminose coltivate sembra essere documentato nella grotta di Filiestru, Grotta del Guano, Sa Ucca de Su Tintirriòlu, Molia (Trump, 1983, 1990). In particolare, la grotta di Filiestru presso Bonu Ighinu è stata interessata da diverse campagne di scavo intraprese tra il 1970 e il 1980 (Trump, 1983). Negli strati del Neolitico antico a ceramica cardiale della trincea D sono state ritrovate alcune cariossidi di farro (Triticum dicoccum) e del piccolo farro (Triticum monococcum) (Trump, 1983). Risale invece al 1971 la prima campagna di scavo condotta presso la grotta Sa ˈUcca de Su Tintirriòlu, in cui si sono rinvenuti numerosi carboni provenienti dalla trincea G negli strati 5 e 6, attribuiti rispettivamente alle fasi culturali del Neolitico medio e recente. Le analisi dei semi carbonizzati, effettuate da Dennel dell’Università di Cambridge, hanno permesso di identificare semi di farro e orzo nudo a sei file (Hordeum vulgare var. nudum). In associazione, sono state identificate anche alcune leguminose, la lenticchia (Lens culinaris) e le vecce (Vicia sp.) (Loria & Trump, 1978). La Grotta del Guano nel territorio di Oliena (Nuoro) è stata oggetto di scavo archeologico nel 1978, nella stessa sono stati ritrovati numerosi resti vegetali carbonizzati le cui analisi hanno confermato la presenza, in strati del Neolitico recente, di orzo vestito (Hordeum vulgare), di frumenti nudi (Triticum compactum) e piselli (Pisum sativum) (Castaldi, 1987; Costantini & Stancanelli, 1984). La Domus de Janas di Molia presso Illorai (Sassari) è stata oggetto di scavo archeologico dal 1976 al 1984, si tratta di una tomba scavata nella roccia dalle comunità del Neolitico recente della cultura di Ozieri (fine IV millennio – prima metà del III millennio a.C.). I resti vegetali rinvenuti al suo interno sono risultati in associazione con materiali ceramici del Neolitico recente. Sono stati identificati cariossidi di frumenti nudi (Triticum aestivum/durum) e orzi (Hordeum sp.). Durante l’età del rame (2700-2400 a.C.), la Sardegna è abitata da nuove comunità che costruiscono grandi muraglie, tombe a circolo, dolmen e menhir (2700-2400 a.C.). La civiltà nuragica ha inizio più tardi, durante l’età del bronzo (1800-1100 a. C.) ed è caratterizzata dalla costruzione di grandi villaggi e numerose torri chiamate nuraghi, delle quali se ne contano attualmente circa 12.000. I Nuraghi, costruzioni uniche in tutto il Mediterraneo occidentale, sono costruiti con massi ciclopici e senza nessun tipo di malta, avevano un’altezza che poteva variare dai 15 ai 30 metri e una funzione sia di tipo difensivo che abitativo/religioso.
Successivamente, tra il IX e il III secolo a.C, fecero ingresso in Sardegna i Fenici e i Cartaginesi. In questo periodo, possiamo distinguere due importanti momenti storici per l’Isola. Nel primo assistiamo all’arrivo dei mercanti fenici, queste prime frequentazioni furono pacifiche e apportarono in Sardegna nuove conoscenze e tecnologie, i Fenici quindi si integrarono con i Nuragici. Ai Fenici si attribuisce il merito di aver introdotto in Sardegna una nuova forma di aggregazione urbana fino ad allora sconosciuta ai Nuragici: la città. A Nora, una stele datata al IX secolo a.C., conservata nel Museo archeologico nazionale di Cagliari, rappresenta il primo esempio di scrittura ritrovato in Occidente. Secondo molti ricercatori tale stele costituisce anche la prima testimonianza attestante il nome scritto usato per denominare la Sardegna. Sulla stele compare infatti il toponimo SHRDN, senza vocali come consuetudine nelle antiche lingue semitiche. I Cartaginesi invece in una seconda fase, colonizzarono l’Isola per lo sfruttamento delle numerose risorse minerarie e per il controllo delle fertili pianure del Campidano. I più importanti insediamenti fenicio/punici si trovano ubicati soprattutto lungo le coste della Sardegna, tra i più importanti vi sono: Nora, Sulki, Monte Sirai, Bithia, Tharros, Othoca, Karalis e Bosa (Barreca, 1988). Nel 238 a.C. i Romani conquistarono la Sardegna al termine della Prima Guerra Punica. Per lungo tempo la dominazione romana fu segnata dalla difficile convivenza con i Nuragici. Gradualmente si raggiunse una certa integrazione, anche se costanti furono le rivolte, in particolare quelle dei Balari e degli Iliensi. I maggiori centri ben presto si romanizzarono e Karalis, l’attuale Cagliari, divenne la capitale della nuova provincia. La città crebbe e fu arricchita di monumenti, tra i quali l’esempio più notevole è probabilmente l’anfiteatro sito nella Valle di Palabanda (Mastino, 2007).
Dopo la caduta dell’Impero romano d’Occidente, la Sardegna fu occupata dai Vandali fino al 534, anno in cui fu conquistata dai Bizantini. Successivamente, con il declino dell’impero di Bisanzio (IX secolo), l’Isola fu divisa in quattro Giudicati retti da un giudice dotato di potere sovrano: Torres-Logudoro, Calari, Gallura e Arborea.
Nel 1297, grazie al volere di papa Bonifacio VIII, ebbe inizio il Regno di Sardegna e Corsica, istituito per reprimere la contesa tra gli Angioni e Aragonesi per il Regno di Sicilia. Così il Regno di Sardegna, attraverso varie fasi percorse l’ultimo periodo del Medioevo sotto la corona d’Aragona, e poi di Spagna.
Intorno al 1479, inizia la storia della Sardegna spagnola. In quell’anno, alla morte di Giovanni II di Aragona, re di Sardegna, gli successe suo figlio Ferdinando II, il cui matrimonio con Isabella di Castiglia sancì la nascita, per unione personale dei due Regni, della Corona di Spagna, di cui il Regno di Sardegna entrava automaticamente a far parte. Nell’agosto del 1708, in piena Guerra di successione spagnola, una spedizione anglo-olandese inviata da Carlo d’Austria pose sotto assedio Cagliari e mise così fine, dopo quasi quattro secoli, alla dominazione iberica sull’Isola. La fine del periodo spagnolo è convenzionalmente posta al momento del passaggio della corona sarda agli Asburgo, con i trattati di Utrecht e Rastatt (1713 e 1714).
Nel 1799 le truppe francesi occuparono il Piemonte costringendo i Savoia a riparare in Sardegna dove rimasero fino al 1814, quando Napoleone Bonaparte fu sconfitto ed esiliato sull’Isola d’Elba.
I Savoia intrapresero una politica di gestione del territorio e di sfruttamento delle risorse, ad esempio col disboscamento per la produzione di carbone, creazione di pascoli e legname per traversine. Per stimolare la produzione agricola come in altre parti d’Europa, nel 1820 Vittorio Emanuele I promulgò l’Editto delle chiudende, con il quale autorizzò la chiusura, con siepi o muri, delle terre comuni. Si consentì quindi, spesso a vantaggio dei latifondisti, la creazione della proprietà privata cancellando la proprietà collettiva dei terreni, tipica dell’Isola.
2. Attività antropiche attuali e pressioni osservate
2.1 Attività antropiche nell’ambiente terrestre
In base al censimento demografico aggiornato al 31 Dicembre 2015 (http://www.istat.it/), i residenti in Sardegna ammontano a 1.658.000. Questo dato certifica la bassa densità antropica (circa 69 abitanti per km2), rispetto alla maggior parte delle regioni italiane ed europee. Lo spopolamento dei piccoli centri, unito all’abbandono delle attività agricole e pastorali, hanno intensificato, dagli anni ‘50 in poi, il processo di concentrazione demografica e delle attività industriali e turistiche lungo la costa (Pungetti et al., 2008). Infatti, le due città più popolate e pressoché costiere (Cagliari e Sassari) registrano un numero di residenti maggiore alle 100.000 unità, seguite da altre due (Quartu Sant’Elena e Olbia), ugualmente prossime al mare, che registrano un numero di residenti maggiore alle 50.000 unità (Fig. 1). La popolazione nelle piccole isole si concentra a La Maddalena (c.a. 11.500 abitanti), Sant’Antioco (c.a. 11.300 abitanti) e S. Pietro (c.a. 6.500 abitanti).
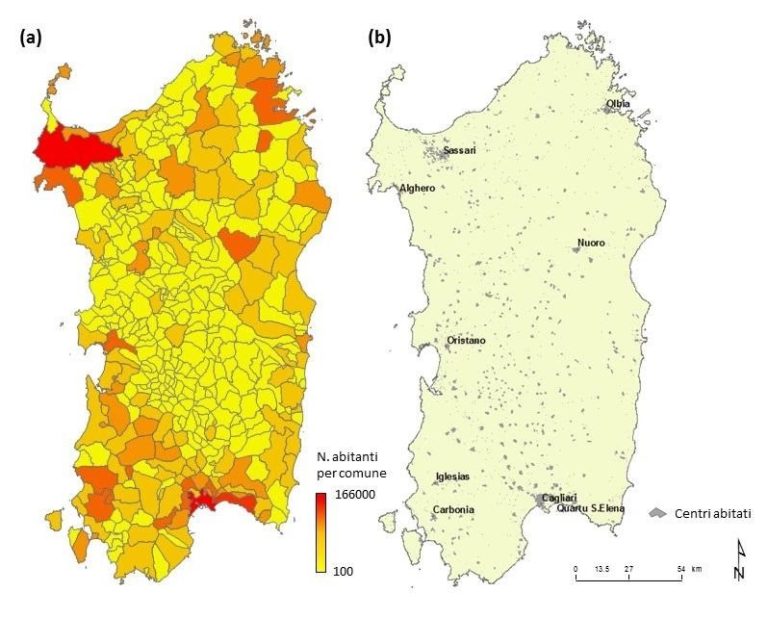
Figura 1. Carta del numero di abitanti per comune (a) e distribuzione dei principali centri abitati (b).
Di conseguenza, le principali minacce per la conservazione della biodiversità in Sardegna sono state rilevate principalmente lungo le aree costiere e sono perlopiù legate a vari disturbi e modificazioni del territorio, quali l’espansione dei centri urbani e delle zone turistiche, le attività industriali e l’implementazione delle reti di trasporto (Fenu et al., 2016). Sebbene, come già accennato, le attività agricole e pastorali dei territori interni dell’Isola si siano ridotte rispetto al passato, l’intensificarsi di prassi meno ecosostenibili (es. espansione di monocolture e uso di fertilizzanti chimici) e l’introduzione di specie non autoctone (sia vegetali che animali), hanno determinato un incremento degli effetti negativi sulla biodiversità legati a tali pratiche (Podda et al., 2012; Puddu et al., 2016). Rimangono altresì ragguardevoli le minacce relative al bracconaggio e l’eccessivo prelievo venatorio che determinano una riduzione della consistenza delle popolazioni di mammiferi e uccelli in particolare.
Più recentemente, indagini relative al riscaldamento globale hanno inoltre evidenziato ulteriori minacce per il prossimo futuro, legate per lo più ai taxa montani che vivono al limite del proprio range altitudinale. Inoltre, tutti i taxa di ambienti costieri potranno risentire del previsto innalzamento del livello del mare e dei fenomeni erosivi in atto. Le piccole isole saranno in questo senso le più suscettibili per le ovvie limitazioni legate all’estensione e al più alto grado di isolamento.
Sebbene i dati pubblicati sulle recenti estinzioni siano difficilmente reperibili per tutto il territorio, non è un caso che la maggior parte dei report in tal senso siano stati pubblicati per le piccole isole (Bocchieri, 1998). Solo per citare alcuni esempi, sono state recentemente riportate cospicue riduzioni delle popolazioni di specie e habitat costieri per fattori legati all’incremento della pressione turistica nelle spiagge e nelle rupi costiere del nord e sud ovest della Sardegna (Farris et al., 2013; Fenu et al., 2013; Fenu et al., 2015a). In particolare, tali lavori hanno evidenziato che anche il semplice calpestio di ambienti molto sensibili può avere un impatto molto evidente sui taxa interessati. Sempre in ambito costiero, il clima di tipo mediterraneo e l’alta resistenza alla salinità hanno permesso l’acclimatazione di molte specie invasive, quali Acacia saligna, Carpobrotus acinaciformis, Cortaderia selloana, Opuntia ficus-indica e Solanum elaeagnifolium, che rappresentano un altro grave problema per la conservazione della biodiversità in ambienti terrestri (Bacchetta et al., 2010; Meloni et al., 2015; Podda et al., 2017).
2.2 Attività antropiche nel dominio marino
Effetti antropogenici di diversa natura coinvolgono il dominio marino. In generale lo sfruttamento delle risorse marine attraverso attività di pesca di vario genere, interessano la totalità delle coste dell’Isola, ad eccezione delle Aree Marine Protette. Pertanto, notevoli differenze nella struttura dei popolamenti ittici si riscontrano tra zone sottoposte a tutela e non (Sala et al., 2012). Interessanti confronti hanno messo in luce che le specie maggiormente beneficiarie della restrizione delle attività umane sono Diplodus sargus, Diplodus vulgaris, Epinephelus marginatus e Sciaena umbra, e che la biomassa prodotta è proporzionale alle attività di sorveglianza contro il bracconaggio (Guidetti et al., 2008). La ristrutturazione di un pool di pesci predatori si riflette inoltre sui popolamenti bentonici come per esempio sulle specie erbivore dell’infralitorale. Tra le specie erbivore che più risentono dell’abbondanza di pesci predatori si annovera il riccio Paracentrotus lividus, anch’esso oggetto di prelievo umano per il consumo delle gonadi, che si stabilisce in popolazioni dense a causa del sovrasfruttamento di predatori (Oliva et al., 2016).
Le valutazioni sullo stato degli organismi marini condotte nei mari di Sardegna, utilizzando sia approcci empirici (indicatori e le loro tendenze temporali) che approcci basati sui modelli di dinamica di popolazione, evidenziano una condizione di sfruttamento delle risorse sicuramente migliore di quella registrata in altre aree italiane. L’attuale condizione di sfruttamento trova origine nell’azione combinata dell’applicazione delle normative gestionali e della contemporanea evoluzione della flotta, registrati nei mari sardi negli ultimi anni. Alla fine degli anni ottanta, nei mari dell’Isola, si riscontrava una generale condizione di “overfishing” delle risorse neritiche a cui si contrapponeva un minore sfruttamento di quelle epi-mesobatiali. Nella fascia costiera, infatti, alla normale attività della pesca artigianale si sovrapponeva quella delle imbarcazioni a strascico di basso tonnellaggio in legno, obsolete e poco adatte a una pesca d’altura. Invece la pesca dei grandi pelagici in Sardegna interessa quasi esclusivamente il tonno rosso, catturato con le tonnare fisse. Queste ultime affondano le loro origini nell’isola alla fine del XV secolo con la dominazione spagnola. Delle 24 tonnare censite in Sardegna ai primi del novecento rimangono attive solo quella dell’Isola di San Pietro e quella di Portoscuso, le uniche nel Mediterraneo.
Inoltre, l’urbanizzazione costiera e la costruzione di porti hanno prodotto importanti alterazioni agli habitat costieri. In generale, il maggiore effetto negativo è dovuto all’eutrofizzazione e all’alterazione della dinamica dei sedimenti che provocano una omogeneizzazione dei fondali, determinando la locale estinzione di praterie di Cystoseira spp. e di Posidonia oceanica. Le aree costiere dell’Isola più densamente popolate e con porti navali (Golfo di Cagliari, Olbia e Porto Torres), sono le aree marine, in cui estese praterie di posidonia sono regredite complessivamente di 23.215 ettari, lasciando spazio a matte morta (Telesca et al., 2015). L’effetto dell’eutrofizzazione costiera interagisce sia con l’aumento della temperatura (dovuta al riscaldamento globale), sia con la presenza di specie introdotte. Pertanto, specialmente nei tratti di costa più densamente popolati e con intenso traffico marittimo, si presentano fioriture di macroalghe esotiche (Caulerpa cylindracea) e microalghe (Chrysophaeum taylorii) che esercitano ulteriori pressioni sui popolamenti autoctoni interagendo con la flora e fauna marina (Caronni et al., 2015). Lo stato delle biocenosi autoctone, già influenzate da altri effetti antropici, non permette un efficace contrasto all’espansione delle specie introdotte.
3. Stato delle conoscenze in materia di biodiversità e conservazione
3.1 Dominio terrestre
Il primo reale contributo alla conoscenza floristica dell’isola risale alla seconda metà del 700, quando Michele Antonio Plazza, titolare della prima cattedra di chirurgia presso l’Università di Cagliari, raccolse nella sua opera le informazioni relative a 851 specie. La prima vera e propria flora dell’Isola risale però al successivo contributo di Moris che, nei tre volumi sulla Flora Sardoa (1823-1859), censì un totale di 1.141 taxa. Con l’intento di completare la flora del Moris, Ugolino Martelli (1860-1934) esplorò ripetutamente l’Isola negli anni compresi tra il 1894 e il 1899, concentrandosi sulle Monocotiledoni non trattate nell’opera di Moris, pubblicando tre fascicoli (1896, 1901, 1904) e descrivendo alcune nuove specie per l’Isola. Successivamente, sebbene numerosi botanici si susseguirono negli anni, per una vera e propria flora aggiornata si dovrà attendere il lavoro di Pignatti (1982) nel quale i taxa descritti per l’Isola incrementarono sino a 2.013 unità. Il dato più aggiornato sull’intera flora, relativo alla checklist di Conti et al. (2007), evidenzia quanto negli ultimi anni il numero complessivo di taxa riconosciuti per la Sardegna sia esponenzialmente aumentato sino ad un numero di 2.494 unità (Fig. 2).
Tenendo conto del continuo ed importante aggiornamento floristico, una flora aggiornata e completa per l’Isola appare tanto impellente, quanto di difficile realizzazione. Nonostante gli sforzi compiuti, i sei volumi sulla Flora dell’Isola di Sardegna (Arrigoni, 2006-2015) necessiterebbero di un costante aggiornamento.
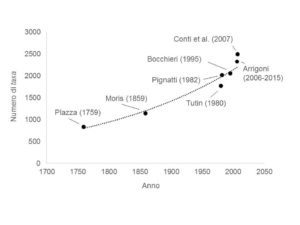
Figura 2. Numero di taxa censiti per l’Isola di Sardegna nel corso degli ultimi secoli.
Per quanto concerne l’esplorazione botanica sulle piccole isole parasarde, i primi veri censimenti si devono a Gennari (1865) sull’Isola di Caprera e a Vaccari (1894) sull’Arcipelago di La Maddalena. Per avere un quadro più completo sui contesti insulari presenti in tutti i settori biogeografici dell’Isola si dovrà però attendere il dopoguerra, quando Martinoli, Desole, Mossa, Arrigoni e Bocchieri, solo per citarne alcuni, hanno contribuito alla realizzazione di inventari floristici completi su 71 isole. Un recente lavoro di revisione ed implementazione dei dati sulle piccole isole parasarde ha reso possibile la definizione ecologica e biogeografica di 81 isole (Fois et al., 2016). In questo lavoro è definita una lista di 105 taxa endemici presenti nelle isole parasarde, dei quali 32 sono stati evidenziati come i più rappresentativi di questi contesti. Inoltre, l’importanza conservazionistica delle piccole isole parasarde è stata confermata dal fatto che circa il 36% della flora endemica è concentrata in questi contesti, nonostante essi rappresentino appena l’1% del territorio sardo. D’altro canto, la presenza di 168 taxa esotici, pari al 35% della flora esotica sarda, è un dato che evidenzia la necessità di interventi volti a contrastare la loro diffusione (Fois et al. 2020).
La tutela e conservazione della flora e della fauna dei territori insulari è disciplinata da trattati e convenzioni internazionali, da direttive e regolamenti comunitari e da leggi a carattere nazionale e regionale. La convenzione di Washington – CITES (1973) “sul commercio internazionale delle specie minacciate di estinzione”, ratificata in Italia con la legge 19 dicembre 1975, n. 874, e la Convenzione di Berna (1979) “sulla protezione della vita selvatica e dell’ambiente naturale in Europa”, ratificata dall’Italia nel 1981 (Legge n. 503/81), sono state le prime due convenzioni internazionali di un certo rilievo. A livello comunitario, la Direttiva Habitat (92/43/CEE) e la Direttiva Uccelli (2009/147/CE), rappresentano il principale strumento per la protezione delle specie animali e vegetali e dei loro habitat. Sono state inoltre disciplinate a livello nazionale le procedure relative all’istituzione delle Aree Protette (Legge 6 dicembre 1991, n. 394), mentre la Legge Regionale 7 giugno 1989, n. 31 sulle « Norme per l’istituzione e la gestione dei parchi, delle riserve e dei monumenti naturali, nonché delle aree di particolare rilevanza naturalistica ed ambientale », solo di recente ha iniziato ad essere attuata. Per quanto riguarda la fauna, la Legge 11 febbraio 1992 n.157 (legge sulla caccia) e la Legge Regionale 29 luglio 1998, n. 23 indicano le specie della fauna selvatica oggetto di tutela e regolano l’esercizio della caccia.
Indipendente dalle normative e dalle convenzioni a vario livello, la conservazione della flora è stata portata avanti in Sardegna da alcuni centri, quali la Banca del Germoplasma della Sardegna (BG-SAR, centro servizi Hortus Botanicus Kalaritanus), il Centro per la Conservazione della Biodiversità (CCB, Università degli Studi di Cagliari) e il Centro Interdipartimentale per la Conservazione e Valorizzazione della Biodiversità Vegetale (CBV, Università degli Studi di Sassari).
Un primo passo è consistito nella determinazione dello stato attuale di conservazione, attraverso l’assegnazione di una categoria secondo i criteri IUCN (2001) a livello regionale. In particolare, lo stato di conservazione dei 23 taxa vegetali inseriti negli allegati I, II e V della Direttiva Habitat (Direttiva 92/43/CEE) è riportato in Rossi et al. (2016); a questi si aggiunge il 48,9% dei taxa esclusivi dell’Isola (91 taxa). In virtù del fatto che alcuni taxa esclusivi sono anche presenti in Direttiva Habitat, un totale di 112 taxa sono stati analizzati per l’Isola (Fenu et al., 2015b). Di questi, esattamente il 50% appartiene ad una categoria di minaccia elevata (CR o EN; Fig. 3). Nella Direttiva Habitat sono riportate 78 entità faunistiche sia marine sia terrestri (alle quali andrebbero aggiunte le specie endemiche di recente descrizione appartenenti a generi già riportati in Direttiva Habitat quali Speleomantes sarrabusensis e Plecotus sardus) e oltre 80 specie di uccelli presenti nell’Allegato I della Direttiva 2009/147/CE del Parlamento Europeo e del Consiglio relativa agli uccelli selvatici.
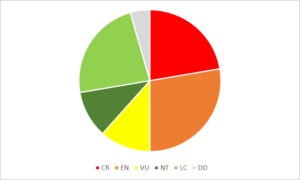
Figura 3. Grafico a torta relativo alle percentuali di taxa vegetali criticamente minacciati (CR), minacciati (EN), vulnerabili (VU), prossimi alla minaccia (NT), poco minacciati (LC) o privi di dati necessari per l’assessment (DD) secondo i criteri e le categorie IUCN (2001).
3.2 Dominio marino
La totalità delle coste dell’Isola consiste in 1.846 km di costa non omogenea, sia come estensione che come caratteristiche oceanografiche, geomorfologiche e bionomiche (Cau et al., 1994; Addis et al., 1998). Dal punto di vista oceanografico, tale area appartiene a due diversi bacini, il bacino Algerino-Provenzale e quello Tirrenico, connessi tra loro dal Canale di Sardegna. Da un punto di vista bati-morfologico i fondi antistanti la Sardegna possono essere distinti in quattro principali zone :
- la costa occidentale (Mar di Sardegna) caratterizzata da una vasta estensione sia dei fondi di piattaforma che di scarpata. Questa condizione, unita alla grande trasparenza delle acque, permette uno sviluppo molto accentuato della vegetazione; tra 0 e 40 metri si hanno infatti estese praterie di fanerogame marine (Posidonia oceanica). A differenza delle altre zone, nella costa occidentale si alternano detritico costiero e coralligeno. I fondali duri presentano le biocenosi tipiche delle pareti verticali. Sono presenti alcune delle più interessanti facies a gorgonacei (Paramuricaea clavata) e corallo rosso (Corallium rubrum). Il margine della piattaforma continentale si caratterizza per la presenza di fondi detritici con concentrazioni elevate del crinoide Leptometra phalangium. Quest’area risulta esposta ai venti provenienti dal terzo e quarto quadrante;
- lungo la costa settentrionale si trovano il Golfo dell’Asinara e le Bocche di Bonifacio, che dividono la Sardegna dalla Corsica. In queste aree la piattaforma continentale è moderatamente estesa mentre la scarpata risulta ridotta e ripida;
- la costa orientale è caratterizzata da fondi adatti ridotti e ripidi, con curva batimetrica dei 1.000 m che decorre molto vicina alla costa. Infatti, da Capo Carbonara alle Bocche di Bonifacio la piattaforma continentale è molto stretta e irregolare, con la presenza di valli sottomarine, sollevamenti e canyon come nel Golfo di Orosei;
- la costa meridionale è caratterizzata principalmente dal Golfo di Cagliari, in queste aree la piattaforma è molto più ampia, specialmente nella porzione occidentale (11 km).
Nel complesso, i popolamenti insulari marini appaiono costituire una fonte di biodiversità più importante di quanto generalmente percepito. Le implicazioni conservazionistiche di ciò sono ovvie: i piani di salvaguardia della biodiversità marina dovrebbero infatti considerare gli habitat insulari tanto per la qualità dell’ambiente che per la qualità delle specie che presentano. Nella situazione attuale di carenza di conoscenze in generale della biodiversità marina, ciò dovrebbe comportare un approccio cautelativo nella pianificazione delle Aree Marine Protette, tale da comprendere aree rappresentative degli habitat insulari. La conservazione degli habitat insulari assume aspetti di particolare priorità data l’attuale crisi della biodiversità marina (Coll et al., 2010) e per la peculiare fragilità presentata dalle piccole popolazioni, anche di invertebrati.
4. Stato di conservazione e gestione
Attraverso la legge quadro 394/91, in Sardegna sono state istituite diverse aree naturali protette. Tra queste, di notevole importanza sono i parchi nazionali dell’Arcipelago di La Maddalena (20.180 ettari terra/mare), dell’Asinara (5.200 ettari) e del Gennargentu e Golfo di Orosei (non operativo) (73.935 ettari). Le aree marine protette (AMP) sono 5: Penisola del Sinis – Isola Mal di Ventre (25.673 ettari), Capo Carbonara – Villasimius (14.360 ettari), Tavolara – Punta Coda Cavallo (15.357 ettari), Capo Caccia – Isola Piana (2.631 ettari) e l’Isola dell’Asinara (10.732 ettari). Inoltre degno di nota è sicuramente il Santuario dei mammiferi marini (Area Naturale Marina di Interesse Internazionale) (2.557.000 ettari). Quest’ultimo è un’AMP compresa nel territorio francese, monegasco e italiano, ed è stata classificata come Area Specialmente Protetta di Interesse Mediterraneo.
Per quanto riguarda invece la normativa regionale, di rilevante importanza conservazionistica sono 4 i parchi naturali regionali istituiti ai sensi della L.R. 31/89: Porto Conte, Molentargius – Saline, Gutturu Mannu (L.R. 20/2014) e Tepilora (L.R. 21/2014).
In accordo con i dati forniti dal Ministero dell’Ambiente (http://www.minambiente.it/pagina/sic-zsc-e-zps-italia), la rete Natura 2000 dei siti istituiti in base alle disposizioni della Direttiva Habitat (92/43/CEE) e Uccelli (2009/147/CE) consiste di 128 aree che includono il 18,86% della superficie terrestre regionale e il 18,29% di quella a mare. In particolare, dei 2.636 siti censiti a livello nazionale, per la Sardegna sono stati individuati 87 Siti di Importanza Comunitaria (SIC/ZSC), 31 Zone a Protezione Speciale (ZPS) e 10 siti SIC-ZSC coincidenti con le ZPS (SIC-ZSC/ZPS). Per quanto riguarda la protezione delle piccole isole parasarde, sono 20 i SIC-ZSC che interessano la protezione di 76 piccole isole (1.411 ettari, pari al 8,38% del territorio terrestre complessivo delle piccole isole) e 12 le ZPS che interessano la protezione di 47 piccole isole (1.344 ettari, pari al 7,99% del territorio terrestre complessivo delle piccole isole). Gli unici tre SIC-ZSC/ZPS interessati proteggono invece ben 64 piccole isole (3.104 ettari, pari al 18,44% del territorio terrestre complessivo delle piccole isole). Tale dato è dovuto al fatto che uno di questi tre siti (SIC/ZPS ITB010008) interessa l’Arcipelago di La Maddalena, il territorio che in Sardegna è più ricco di piccole isole. In aggiunta, gli altri due ZSC/ZPS sono stati istituiti esclusivamente per la protezione di altre due piccole isole della Sardegna sud-occidentale: Isola del Toro (ITB040026) e Isola della Vacca (ITB040081).
A livello nazionale sono protetti complessivamente 131 habitat, 90 entità floristiche e 113 entità faunistiche ai sensi della Direttiva Habitat. Sono 387 le entità avifaunistiche protette ai sensi della Direttiva Uccelli. Di questi, nel sottobacino della Sardegna sono presenti 60 habitat, di cui 13 prioritari e 23 entità floristiche (Biondi et al., 2014).
5. Strategie di conservazione
In base all’Art. 11 della Direttiva, gli Stati membri devono garantire la sorveglianza dello stato di conservazione (SC) delle specie e degli habitat, principalmente indicati sulla base dell’area di ripartizione, popolazioni, habitat a cui è riferibile e trend futuri prevedibili. La Direttiva richiede per le specie il raggiungimento ed il mantenimento di uno status favorevole e impone una verifica agli Stati membri ogni 6 anni (reporting ex Art. 17). Esso implica una valutazione un assessment nazionale con cui valutare lo SC di ogni specie di interesse comunitario, all’interno di ciascuna regione biogeografica. Tali monitoraggi sono necessari anche per ottenere indicazioni circa i trend passati, di breve (12 anni, due cicli di reporting) e lungo termine (24 anni).
In assenza di un piano nazionale di monitoraggio, le attività previste dalle norme europee sono state portate avanti, spesso in maniera disomogenea e non coordinata, dai centri di ricerca o istituzioni che operano a livello regionale. In tale contesto, in Sardegna, il Centro Conservazione Biodiversità (CCB) e la Banca del Germoplasma della Sardegna (BG-SAR), strutture dell’Università degli Studi di Cagliari, hanno intrapreso studi dal punto di vista tassonomico, biosistematico, ecologico e di monitoraggio delle specie a rischio d’estinzione, con il fine di proporre le strategie più adeguate per la loro conservazione. Specificamente, il CCB promuove una strategia di monitoraggio delle popolazioni delle specie vegetali di interesse conservazionistico, selezionate sulla base di un ranking di priorità (Bacchetta et al., 2012a), al fine di seguirne i trend evolutivi e definirne lo stato di conservazione e, congiuntamente, BG-SAR attua strategie di conservazione ex-situ al fine di salvaguardare la diversità floristica della Sardegna.
Un primo approccio a tali tematiche è avvenuto durante il progetto Interreg III B “Genmedoc” (2004-2006), che ha consentito di avviare le indagini su 16 taxa endemici presenti all’interno di aree di interesse comunitario (Bacchetta et al., 2008). Il progetto rientrava nelle azioni comuni in materia ambientale dell’Unione Europea per la protezione della biodiversità e la conservazione delle specie e degli habitat mediterranei e, principalmente, di quelli prioritari presenti nei SIC della Rete Natura 2000. Tra le azioni principali vi era l’elaborazione di protocolli comuni di gestione, combinando la conservazione ex situ (raccolta, conservazione e testaggio del germoplasma), con quella in situ (monitoraggio, recupero e implementazione delle popolazioni naturali). Nell’ambito del progetto sono stati avviati i monitoraggi popolazionali per due specie prioritarie della Direttiva Habitat: Astragalus maritimus e A. verrucosus. Per tali taxa è stato possibile aggiornare le conoscenze biologiche, ecologiche e distributive, acquisendo informazioni sulla consistenza e struttura delle popolazioni, oltre che sulla natura e intensità delle principali minacce (Bacchetta et al., 2011). Nel corso del progetto è stato possibile raccogliere, conservare e caratterizzare il germoplasma di due specie endemiche della Sardegna, Borago morisiana e Brassica insularis, raccolte rispettivamente presso l’Isola di San Pietro e l’Isola dei Cavoli, come pure elaborare i protocolli efficaci di germinazione e moltiplicazione per B. insularis.
Successivamente le attività di monitoraggio e di studio delle popolazioni sono state implementate per altri taxa, attraverso numerosi progetti di conservazione delle specie vegetali endemiche a rischio di estinzione della Sardegna. In particolare, il progetto di conservazione delle piante endemiche esclusive, finanziato dalla Regione Sardegna (2007-2010), ha consentito di definire una “priority list” delle specie endemiche per le quali era urgente avviare azioni di conservazione (Bacchetta et al., 2012a). Tale ranking è stato elaborato considerando due capisaldi fondamentali: 1) ottemperare alle direttive europee per le specie di interesse comunitario e 2) applicare il criterio di “responsabilità regionale” (Bacchetta et al., 2012a, b) per la conservazione dei taxa esclusivi dell’Isola. Sono quindi stati avviati i monitoraggi, gli studi e le azioni di conservazione sui primi 10 taxa a maggior rischio di estinzione, 4 dei quali inclusi nella Direttiva come specie prioritarie. Tali protocolli sono stati perfezionati durante successivi progetti che hanno coinvolto numerosi taxa endemici o di interesse conservazionistico, tra i quali: Polygala sinisica, Anchusa littorea, Dianthus morisianus, Helianthemum caput-felis, Gentiana lutea subsp. lutea, Rhamnus persicifolia, Ribes multiflorum ssp. sandalioticum e Silene velutina. Ulteriori azioni di conservazione in situ specifiche hanno coinvolto specie quali Astragalus gennarii, Centaurea magistrorum, Borago morisiana, Epipactis palustris, Senecio morisii e Ophioglossum vulgatum.
Nel corso dei primi 20 anni di attività, BG-SAR ha prestato particolare attenzione alla conservazione delle unità tassonomiche endemiche, rare e minacciate della Sardegna, tra cui quelle presenti nei territori insulari, e si è impegnata costantemente a preservare il germoplasma relativo a questi taxa. In particolare, la struttura conserva diverse accessioni riferibili a taxa provenienti dall’Isola di San Pietro (Astragalus maritimus, Borago morisiana, Helicodiceros muscivorus e Genista valsecchiae), Isola dei Cavoli (Brassica insularis, Bryonia marmorata, Helicodiceros muscivorus, Ferula arrigonii e Silene valsecchiae), Isola di Serpentara (Helicodiceros muscivorus, Ferula arrigonii, Scrophularia trifoliata e Verbascum conocarpum subsp. conocarpum), Arcipelago di La Maddalena (Bellium bellidioides, Helicodiceros muscivorus, Ferula arrigonii e Silene velutina), Isola del Toro (Silene martinolii) e Isola di Tavolara (Sesleria insularis e Ferula arrigonii) e per molti di questi taxa sono stati elaborati e sono noti i protocolli ottimali di germinazione e moltiplicazione.
La Banca del Germoplasma della Sardegna (BG-SAR)
La Banca del Germoplasma della Sardegna (BG-SAR) è una struttura del centro servizi HBK (Hortus Botanicus Karalitanus), nata nel 1997 grazie alla collaborazione tra l’allora Dipartimento di Scienze Botaniche (oggi Dipartimento di Scienze della Vita e dell’Ambiente, DiSVA) e l’Amministrazione Provinciale di Cagliari. BG-SAR agisce sull’intero territorio regionale sardo e più in generale sui territori insulari del Mediterraneo, in collaborazione con altri istituti di ricerca e centri di conservazione della biodiversità vegetale europei e nordafricani. L’obiettivo principale della Banca è la raccolta, studio, conservazione e gestione del germoplasma relativo alle unità tassonomiche endemiche, rare, minacciate o comunque di particolare interesse fitogeografico. Per la gestione del germoplasma vengono seguite le procedure e i protocolli riconosciuti a livello internazionale, e in particolare quelli della FAO/IPGRI (1994), ISTA (2006) e Bacchetta et al. (2006), adattati per i semi di piante spontanee. Nello specifico, il germoplasma raccolto in campo viene temporaneamente stoccato in un locale per la quarantena e post-maturazione prima di essere introdotto nella banca vera e propria. Ogni accessione viene poi analizzata sia dal punto qualitativo che quantitativo. Una volta selezionato, il germoplasma viene stoccato in una camera di deidratazione (temperatura di 15°C e umidità relativa del 15%), all’interno della quale viene costantemente monitorato il contenuto di umidità interna dei semi in modo da poter valutare il grado di deidratazione e il raggiungimento dei parametri ottimali per la conservazione a lungo termine, che per la collezione di base viene effettuata a -25°C. Quando il quantitativo lo permette, un sub-lotto di ogni accessione viene inoltre conservato ad una temperatura di 5°C (collezione attiva), utile per l’esecuzione di studi e test quali le prove di germinazione. Parte del materiale raccolto e conservato di cui si possiede una grande quantità di semi, può essere messo a disposizione per scambi e/o per finalità di ricerca attraverso l’Index Seminum, .
Negli ultimi anni, la struttura ha focalizzato i propri sforzi anche sulla conservazione delle specie di interesse agricolo a rischio di estinzione, sia spontanee che coltivate, come pure specie riconducibili a parenti spontanei delle attuali coltivate (CWR, Crop Wild Relatives; Porceddu et al., 2017). Vengono altresì studiate unità tassonomiche nell’ambito di progetti di conservazione a livello locale o finalizzati al recupero ambientale. In particolare si effettuano studi sulle specie metallo-tolleranti con comportamento pioniero su substrati contaminati delle aree minerarie dismesse della Sardegna. Viene inoltre indagata la biologia riproduttiva di specie esotiche invasive di origine neo e paleotropicale (Porceddu et al., 2017).
BG-SAR rappresenta l’unica struttura in Sardegna autorizzata dal Ministero dell’Ambiente e della Tutela del Territorio e del Mare per la raccolta delle unità tassonomiche inserite negli allegati della DIR. 92/43/CEE, in deroga al DPR n. 357/97 (mod. dal DPR n. 120/03).
Rete Regionale per la conservazione della Fauna Marina Sardegna
Le tartarughe e i mammiferi marini sono considerate specie minacciate e in pericolo di estinzione. In particolare, le tartarughe marine sono soggette a diverse tipologie di pressioni. Le minacce più significative sono dovute allo sviluppo costiero e al turismo, all’inquinamento luminoso, alla pesca commerciale a fini alimentari, industriali e ornamentali (ancora permessa o tollerata in certe regioni), all’inquinamento marino e alle morti accidentali, dovute a imbarcazioni da diporto, a reti derivanti, ad ami e infine a sacchetti di plastica che possono soffocarle. Contribuiscono alla conservazione il divieto di commercio e trasporto internazionale, in base alla Convenzione di Washington (CITES), la cui attuazione in Sardegna è delegata alle Direzioni generali dell’Assessorato della Difesa dell’Ambiente e del Corpo Forestale e di Vigilanza Ambientale che hanno avviato dal 2005 una collaborazione con le Aree Marine Protette e i Parchi Nazionali della Sardegna, finalizzata al recupero e alla conservazione della fauna marina.
Oltre agli enti pubblici, fanno parte della rete professionisti e associazioni private che collaborano a stretto contatto tra loro. Tale collaborazione ha consentito di operare congiuntamente nell’ambito costiero regionale garantendo la capillarità degli interventi di recupero.
Fanno attualmente parte della Rete Regionale per la conservazione della fauna marina:
– la Regione Autonoma della Sardegna con la Direzione generale della Difesa dell’Ambiente
– il Servizio Tutela della natura e politiche forestali e la Direzione generale del Corpo Forestale e di Vigilanza Ambientale
– le Capitanerie di Porto – Guardia costiera con le Direzioni marittime di Cagliari e Olbia
– la Stazione Zoologica Anton Dohrn di Napoli
– i Parchi Nazionali Arcipelago di La Maddalena e Isola dell’Asinara
– le Aree Marine Protette della Sardegna “Capo Caccia-Isola Piana”, “Tavolara-Capo Coda Cavallo”, “Penisola del Sinis-Isola di Mal di Ventre” e “Capo Carbonara”
– il Comune di Pula in collaborazione con il Centro Recupero Cetacei e Tartarughe marine “Laguna di Nora”.
L’attività della Rete Regionale per la Conservazione della Fauna Marina ha consentito il recupero e il soccorso di diverse specie, in particolar modo di Caretta caretta, Chelonia mydas e Dermochelys coriacea, oltre al soccorso e la liberazione di mammiferi marini quali delfini, tursiopi, stenelle, etc.
Oltre ad effettuare attività finalizzate alla conservazione i vari nodi della rete si occupano di svolgere incontri informativi e di sensibilizzazione nelle scuole. La rete promuove e realizza, con il coinvolgimento dei pescatori, degli operatori turistici e dei centri diving, lo sviluppo di una maggiore sensibilità verso la salvaguardia degli ecosistemi marini, favorendo inoltre la diffusione di buone pratiche e di comportamenti corretti volti a prevenire e ridurre le cause di mortalità legate all’antropizzazione.
Riferimenti bibliografici
-
Addis P., Campisi S., Cuccu D., Follesa M.C., Murenu M., Sabatini A., Secci E. & Cau A., 1998. Mari di Sardegna: sintesi delle ricerche sulla pesca a strascico negli anni 1985-1997. Biologia Marina Mediterranea, 5, 85-95.
-
ANPA, 2001. La biodiversità nella regione geografica mediterranea. Stato dell’Ambiente 4/2001.
-
Bacchetta G., Iiriti G., & Pontecorvo C., 2005. Contributo alla conoscenza della flora vascolare endemica della Sardegna. Informatore Botanico Italiano, 37, 306-307.
-
Bacchetta G., Fenu G., Mattana E., Piotto B., & Virevaire M., 2006. Manuale per la raccolta, studio, conservazione e gestione ex situ del germoplasma (Vol. 37). APAT-Agenzia per la protezione dell’ambiente e per i servizi tecnici. pp. 244.
-
Bacchetta G., Casti M., Mossa L., & Piras M.L., 2007. La flora del distretto minerario di Montevecchio (Sardegna sud-occidentale). Webbia, 62, 27-52.
-
Bacchetta G., Fenu G., & Mattana E., 2008. Studi di biologia della conservazione di specie vegetali endemiche della Sardegna nell’ambito del progetto “GENMEDOC”. Webbia, 63(2), 293-307.
-
Bacchetta G., Bagella S., Biondi E., Farris E., Filigheddu R. S., & Mossa L., 2009. Vegetazione forestale e serie di vegetazione della Sardegna (con rappresentazione cartografica alla scala 1: 350.000). Fitosociologia, 46, 1-82.
-
Bacchetta G., Dettori C.A., Mascia F., Meloni F., & Podda L., 2010. Assessing the potential invasiveness of Cortaderia selloana in Sardinian wetlands through seed germination study. Plant Biosystems, 144, 518-527.
-
Bacchetta G., Fenu G., Mattana E., & Pontecorvo C., 2011. Ecological remarks on Astragalus maritimus and A. verrucosus, two threatened exclusive endemic species of Sardinia. Acta Botanica Gallica, 158, 79-91.
-
Bacchetta G., Farris E., & Pontecorvo C., 2012a. A new method to set conservation priorities in biodiversity hotspots. Plant Biosystems, 146, 638-648.
-
Bacchetta G., Fenu G., & Mattana E., 2012b. A checklist of the exclusive vascular flora of Sardinia with priority rankings for conservation. Anales del Jardín Botánico de Madrid, 69, 81-89.
-
Ballesteros E., 2003. The Coralligenous in the Mediterranean Sea. RAC/SPA- Regional Activity Centre for Specially Protected Areas.
-
Barreca F., 1988. La civiltà fenicio punica in Sardegna. Carlo Delfino Editore, Sassari.
-
Biondi E., Blasi C., Allegrezza M., Anzellotti I., Azzella M.M., Carli E., Casavecchia S., Copiz R., Del Vico E., Facioni L., Galdenzi D., Gasparri R., Lasen C., Pesaresi S., Poldini L., Sburlino G., Taffetani F., Vagge I., Zitti S., & Zivkovic L., 2014. Plant communities of Italy : The Vegetation Prodrome. Plant Biosystems, 148, 728-814.
-
Bocchieri E., 1998. On the failure to find plants on some minor islands of Sardinia. Flora Mediterranea, 8, 197-212.
-
Bouduresque C.F., 2004. Marine biodiversity in the Mediterranean: status of species, populations and communities. Scientific Reports of Port-Cros national park, 20, 97-146.
-
Bulgarini F., Petrella S., & Teofili C., 2006. Biodiversity Vision dell’Ecoregione Mediterraneo Centrale. WWF Italia-MIUR, Roma.
-
Carmignani L., Oggiano G., Funedda A., Conti P., & Pasci S., 2016. The geological map of Sardinia (Italy) at 1:250,000 scale. Journal of Maps, 12, 826-835.
-
Caronni S., Calabretti C., Delaria M.A., Bernardi G., Navone A., Occhipinti-Ambrogi A., Panzalis P., & Ceccherelli G., 2015. Consumer depletion alters seagrass resistance to an invasive macroalga. PLoS ONE, 10, e0115858.
-
Castaldi E., 1987. Grotta del Guano di Oliena. Relazione preliminare dello scavo 1978. In: Protostoria IIdPe (ed) Atti della XXVI riunione scientifica. Il Neolitico in Italia – Firenze 7-10 novembre 1985, Vol. 2. Firenze, pp. 831-843.
-
Cau A., Sabatini A., Murenu M., Follesa M.C., & Cuccu D., 1994. Considerazioni sullo stato di sfruttamento delle risorse demersali (Mari di Sardegna). Biologia Marina Mediterranea, 1, 67-76.
-
Cau A., Cannas R., Sacco F., & Follesa M.C., 2013. Adaptive management plan for red coral, Corallium rubrum, in the GFCM competence area. GFCM, Rome.
-
Coll M., Piroddi C., Steenbeek J., Kaschner K., Rais Lasram F.B., Aguzzi J., Ballesteros E., Nike Bianchi C., Corbera J., Dailianis T., et. al., 2010. The Biodiversity of the Mediterranean Sea: Estimates, Patterns, and Threats. PLoS ONE, 5, e11842.
-
Conti F., Manzi A., & Pedrotti F., 1997. Liste rosse regionali delle piante d’Italia. Dipartimento di Botanica ed Ecologia. Università degli Studi di Camerino, Camerino.
-
Conti F., Abbate G., Alessandrini A., & Blasi C. (Eds.), 2005. An annoted checklist of the Italian vascular flora. Palombi Editori, Roma, Italia, 420 pp.
-
Conti F., Alessandrini A., Bacchetta G., Banfi E., Barberis G., Bartolucci F., Bernardo L., Bonacquisti S., Bouvet D., Bovio M., Brusa G., Del Guacchio E., Foggi B., Frattini S., Galasso G., Gallo L., Gangale C., Gottschlich G., Grünanger P., Gubellini L., Iiriti G., Lucarini D., Marchetti D., Moraldo B., Peruzzi L., Poldini L., Prosser F., Raffaelli M., Santangelo A., Scassellati E., Scortegagna S., Selvi F., Soldano A., Tinti D., Ubaldi D., Uzunov D., & Vidali M., 2007. Integrazioni alla checklist della flora vascolare italiana. Natura Vicentina, 10, 5-74.
-
Corti C., Capula M., Luiselli L., Razzetti E., & Sindaco R., 2010. Fauna d’Italia. Reptilia. Calderini – Edizioni Calderini de Il Sole 24 Ore S.p.A. Bologna, 876 pp.
- Cossu I. M., Frau S., Delfino M., Chiodi A., Corti C., Bellati A. (2018). First report of Bufo bufo (Linnaeus, 1758) from Sardinia (Italy). Acta Herpetologica, 13(1): 43-49. http://dx.doi.org/10.13128/Acta_Herpetol-21867
-
Dellacasa M. & Dellacasa G., 2008. Revision of the genus Chelotrupes Jekel, 1866 n. stat. (Insecta, Coleoptera, Geotrupidae). Zoosystema, 30, 629-640.
-
De Mattia W. & Mascia F., 2014. On the identity of Helix dohrni Paulucci 1882 and Helix hillyeriana paulucci 1882, with the description of two new Xerosecta species (Pulmonata: Hygromiidae) from Sardinia (Western Mediterranean). Journal of Conchology, 41(5): 1-13.
-
Di Franco A., Bussotti S., Navone A., Panzalis P., & Guidetti P., 2009. Evaluating effects of total and partial restrictions to fishing on Mediterranean rocky-reef fish assemblages. Marine Ecology Progress Series, 387, 275-285.
-
Farris E., Pisanu S., Ceccherelli G., & Filigheddu R., 2013. Human trampling effects on Mediterranean coastal dune plants. Plant Biosystems, 147, 1043-1051.
-
Fenu G., Cogoni D., Ulian T., & Bacchetta G., 2013. The impact of human trampling on a threatened coastal Mediterranean plant: The case of Anchusa littorea Moris (Boraginaceae). Flora, 208, 104-110.
-
Fenu G., Cogoni D., Sulis E., & Bacchetta G., 2015a. Ecological response to human trampling and conservation status of Helianthemum caput-felis (Cistaceae) at the eastern periphery of its range. Acta Botanica Gallica, 162, 191-201.
-
Fenu G., Fois M., Cogoni D., Porceddu M., Pinna M.S., Cuena-Lombraña A., Nebot A., Sulis E., Picciau R., Santo A., Murru V., Orrù M., & Bacchetta G., 2015b. The Aichi Biodiversity Target 12 at regional level: an achievable goal? Biodiversity, 16, 120-135.
-
Fenu G., Bacchetta G., Giacanelli V., Gargano D., Montagnani C., Orsenigo S., Cogoni D., Rossi G., Conti F., Santangelo A., et al., 2016. Conserving plant diversity in Europe: outcomes, criticisms and perspectives of the Habitats Directive application in Italy. Biodiversity and Conservation, 26, 309-328.
-
Fois M., Fenu G., & Bacchetta G., 2016. Global analyses underrate part of the story: finding applicable results for the conservation planning of small Sardinian islets’ flora. Biodiversity and Conservation, 25, 1091-1106.
-
Fois, M., Podda, L., Médail, F., & Bacchetta, G., 2020. Endemic and alien vascular plant diversity in the small Mediterranean islands of Sardinia: Drivers and implications for their conservation. Biological Conservation, 244: 108519.
-
Grussu M., 2001.Checklist of the birds of Sardinia. Updated to December 2001. Aves Ichnusae, 4, 1-55.
-
Guidetti P., Bianchi C.N., Chiantore M., Schiaparelli S., Morri C., & Cattaneo-Vietti R., 2004. Living on the rocks: Substrate mineralogy and the structure of subtidal rocky substrate communities in the Mediterranean Sea. Marine Ecology Progress Series, 274, 57-68.
-
Guidetti P., Bussotti S., Panzalis P., & Navone A., 2007. Fish fauna associated with the Coralligenous formations of the ‘Papa Rocky Banks’ (‘Tavolara – Punta Coda Cavallo’ Marine Protected Area, NE Sardinia, Italy). Biologia Marina Mediterranea, 14, 160-161.
-
Guidetti P., Milazzo M., Bussotti S., Molinari A., Murenu M., Paise A., Spanò N., Balzano R., Agardy T., Boero F., et al., 2008. Italian marine reserve effectiveness: Does enforcement matter? Biological Conservation, 141, 699-709.
-
Harmelin-Vivien M.L., 1983. Ichtyofaune des herbiers de posidonies des cotes provencales francaises. Rapp. Comm. int. Mer Médit., 28, 161-163.
-
Lanza B., Andreone F., Bologna M., Corti C. & Razzetti E., 2007. Fauna d’Italia. Amphibia. Calderini – Edizioni Calderini de Il Sole 24 Ore S.p.A. Bologna, 540 pp.
-
Lilliu G., 2004. La civiltà dei Sardi: dal Paleolitico all’età dei nuraghi. Il Maestrale, Nuoro.
-
Lorìa R. & Trump D.H., 1978. Le scoperte a Sa ucca de su Tintirriòlu e il neolitico sardo. Accademia nazionale dei Lincei.
-
Lugliè C., 2003. La ceramica di facies S. Ciriaco tra Neolitico medio e superiore: evoluzione interna o apporti extrainsulari? In: Atti della XXXV Riunione Scientifica dell‟Istituto Italiano di Preistoria e Protostoria Le comunità della preistoria italiana. Studi e ricerche sul neolitico e le età dei metalli in memoria di Luigi Bernabò Brea (Lipari, 2-7 giugno 2000). IIPP, Firenze, pp. 723-733.
-
Lugliè C., 2009. Il Neolitico Antico. In: Atti della XLIV Riunione Scientifica dell’IIPP La preistoria e la protostoria della Sardegna (Cagliari-Barumini-Sassari, 23-28 novembre 2009). Vol 1. IIPP, Firenze, pp. 37-47.
-
Mansion G., Rosenbaum G., Schoenenberger N., Bacchetta G., Rosselló J.A., Conti E., & Fishbein M., 2008. Phylogenetic analysis informed by geological history supports multiple, sequential invasions of the Mediterranean basin by the angiosperm family Araceae. Systematic Biology, 57, 269-285.
-
Marra, S., Coppa S., Camedda A., Mazzoldi C., Wrachien F., Massaro G., & De Lucia G.A., 2016a. Recovery trends of commercial fish: The case of an underperforming mediterranean marine protected area. PLoS ONE, 11, e0146391.
-
Marra S., De Lucia G.A., Camedda A., Espinosa F., & Coppa S., 2016b. New records of the distribution and conservation status of the endangered limpet Patella ferruginea in Sardinia (Italy, W Mediterranean). Aquatic Conservation: Marine and Freshwater Ecosystems, 26, 607-612.
-
Masseti M., 2002. Uomini e (non solo) topi. Gli animali domestici e la fauna antropocora. Firenze University Press, Università di Firenze, Firenze.
-
Masseti M., 2009a. A possible approach to the “conservation” of the mammalian populations of ancient anthropochorous origin of the Mediterranean islands. Folia Zoologica, 58, 303-308.
-
Masseti M., 2009b. Mammals of the Mediterranean islands: homogenisation and loss of biodiversity. Mammalia, 73, 169-202.
-
Mastino A., 2007. Storia della Sardegna antica. Il Maestrale, Nuoro.
-
Meloni F., Dettori C.A., Mascia F., Podda L., & Bacchetta G., 2015. What does the germination ecophysiology of the invasive Acacia saligna (Labill.) Wendl. (Fabaceae) teach us for its management?. Plant Biosystems, 149, 242-250.
-
Minelli A., & Stoch F., 2005. La checklist delle specie della fauna italiana. In Ruffo S. & Stoch F. (eds.) Checklist e distribuzione della fauna italiana. Memorie del Museo Civico di Storia Naturale di Verona. 2.a serie. Sezione Scienze della Vita, 16, 21-23.
-
Mucedda M., Kiefer A., Pidinchedda E., & Veith M., 2002. A new species of long-eared bat (Chiroptra, Vespertilionidae) from Sardinia (Italy). Acta Chiropterologica, 4, 121-135.
-
Mucedda M. & Pidinchedda E., 2010. Pipistrelli in Sardegna. Conoscere e tutelare i mammiferi volanti. MATTM e Regione Autonoma della Sardegna. Nuova Stampa Color – Muros.
-
Oliva S., Farina S., Pinna S., Guala I., Agnetta D., Ariotti P.A., Mura F., & Ceccherelli G., 2016. Determinants of Paracentrotus lividus sea urchin recruitment under oligotrophic conditions: Implications for conservation management. Marine Environmental Research, 117, 13-20.
-
Pagliano G. & Strumia F., 2019. Il genere Smicromyrme in Sardegna con descrizione di una nuova specie (Insecta: Hymenoptera: Mutillidae). Quaderno di Studi e Notizie di Storia Naturale della Romagna, 49: 253-261.
-
Pederzani F., Rocchi S., & Schizzerotto A., 2004. Un nuovo ditiscide semi-igropetrico di Sardegna: Hydroporus (Sternoporus) sardomontanus n. sp. (Coleoptera Dytiscidae). Atti dell’Accademia Roveretana degli Agiati, Rovereto, 254, 127-137.
-
Pessina A. & Tiné V., 2008. Archeologia del neolitico: l’Italia tra VI e IV millennio a.C. Carrocci, Roma.
-
Pignatti S., 1982. La flora d’Italia. Edagricole, Bologna.
-
Podda L., Lazzeri V., Mascia F., Mayoral O., & Bacchetta G., 2012. The checklist of the Sardinian alien flora: an update. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 40, 14.
-
Podda L., Santo A., Leone C., Mayoral O., & Bacchetta G., 2017. Seed germination, salt stress tolerance and seedling growth of Opuntia ficus-indica (Cactaceae), invasive species in the Mediterranean Basin. Flora, 229, 50-57.
-
Poggi R. , Fancello L. & Leo P., 2021. Revisione del genere Trogasteropsis Dodero, 1918, con descrizione di undici nuove specie di Sardegna (Coleoptera, Staphylinidae, Pselaphinae). Annali del Museo Civico di Storia Naturale “G. Doria”, 114: 267-314.
- Porceddu, M., Santo, A., Orru, M., Meloni, F., Ucchesu, M., Picciau, R., … & Bacchetta, G. (2017). Seed conservation actions for the preservation of plant diversity: The case of the Sardinian Germplasm Bank (BG-SAR). Plant Sociology, 54(2), 111-117.
-
Puddu S., Podda L., Mayoral O., Delage A., Hugot L., Petit Y., & Bacchetta G., 2016. Comparative analysis of the alien vascular flora of Sardinia and Corsica. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 44, 337-346.
-
Pungetti G., Marini A., & Vogiatzakis I.N., 2008. Sardinia. In: . Pungetti G. & Mannion A.M. (eds.) Mediterranean Island Landscapes: Natural and Cultural Approaches. Dordrecht, Springer, 9, 143-169.
-
Rivas-Martínez S., 2007. “Mapa de series, geoseries y geopermaseries de vegetación de España” [Map of series, geoseries and geopermaseries of vegetation in Spain]. Itinera Geobotanica, 17, 5-436.
-
Rocchi S., 2011. Contribution to the knowledge of the Hydrophiloidea of Sardinia (Coleoptera: Hydrochidae, Hydrophilidae, Sphaeridiidae, Spercheidae). In: Nardi G., Whitmore D., Bardiani M., Birtele D., Mason F., Spada L. & Cerretti P. (eds), Biodiversity of Marganai and Montimannu (Sardinia). Research in the framework of the ICP Forests network. Conservazione Habitat Invertebrati, 5, 287-311.
-
Rossi G., Orsenigo S., Montagnani C., Fenu G., Gargano D., Peruzzi L., Wagensommer RP., Foggi B., Bacchetta G., Domina G. Conti F., Bertolucci F., Gennai M., Ravera S., Cogoni A., Magrini S., Gentili R., Castello M., Blasi C., & Abeli T., 2016. Is legal protection sufficient to ensure plant conservation? The Italian red list of policy species as a case study. Oryx, 50, 431-436.
-
Ruffo S. & Stoch F. (eds.) 2005. Checklist e distribuzione della fauna italiana. Memorie del Museo Civico di Storia Naturale di Verona, 2a serie, Sezione Scienze della Vita, 16, 307 pp.
-
Sala E., Ballesteros E., Dendrinos P., Di Franco A., Ferretti F., Foley D., Fraschetti S., Friedlander A., Garrabou J., Güçlüsoy H., et al., 2012. The structure of Mediterranean rocky reef ecosystems across environmental and human gradients, and conservation implications. PLoS ONE, 7, e32742.
-
Scotti G. & Chemello R., 2000. I Molluschi marini mediterranei degni di protezione: stato delle conoscenze e forme di tutela. Bollettino Malacologico, Roma. 36, 61-70.
-
Schultze N., Spitzweg C., Corti C., Delaugerre M., Di Nicola M.R., Geniez P., Lapini L., Liuzzi C., Lunghi E., Novarini N., Picariello O., Razzetti E., Sperone E., Stellati L., Vignoli L., Asztalos M., Kindler C., Vamberger C. & Fritz U., 2020. Mitochondrial ghost lineages blur phylogeography and taxonomy of Natrix helvetica and N. natrix in Italy and Corsica. Zoologica Scripta, 49: 395-411. https://doi.org/10.1111/zsc.12417
-
Stoch F. & Genovesi P. (eds.), 2016. Manuali per il monitoraggio di specie e habitat di interesse comunitario (Direttiva 92/43/CEE) in Italia: specie animali. ISPRA, Serie Manuali e linee guida, 141/2016.
-
Taiti S. & Argano R., 2009. New species of terrestrial isopods (Isopoda: Oniscidea) from Sardinia. In: Cerretti, P., Mason, F., Minelli, A., Nardi, G. & Whitmore, D. (eds), Research on the Terrestrial Arthropods of Sardinia (Italy). Zootaxa, 2318, 1-602.
-
Taiti S. & Argano R., 2011. Oniscidea di Sardegna (Crustacea, Isopoda). In: Nardi G., Whitmore D., Bardiani M., Birtele D., Mason F., Spada L. & Cerretti P. (eds), Biodiversity of Marganai and Montimannu (Sardinia). Research in the framework of the ICP Forests network. Conservazione Habitat Invertebrati, 5, 163-222.
-
Telesca L., Belluscio A., Criscoli A., Ardizzone G, Apostolaki E.T., Fraschetti S., Gristina, M, Knittweis L., Martin C.S., Pergent G., Alagna A., et al., 2015. Seagrass meadows (Posidonia oceanica) distribution and trajectories of change. Scientific Reports, 5, 12505.
-
Trump D.H., 1983. La Grotta di Filiestru a Mara (SS). Quaderni della Soprintendenza ai Beni Archeologici per le Provincie di Sassari e Nuoro, 13, 1-108.
-
Trump D.H., 1990. Nuraghe Noeddos and the Bonu Ighinu Valley: excavation and survey in Sardinia. Oxbow Books in association with the Ministero per i Beni culturali e ambientali.
-
Zanetti M., Turin P., Piccolo D., Bellio M., Floris B., Bua R., Cottiglia C. & Liggi G., 2010. Distribuzione della fauna ittica nei principali bacini idrografici della Provincia di Cagliari. Studi Trentini di Scienze Naturali, 87, 269-271.
| NOME DEL CLUSTER | NOME DELLE ISOLE E DEGLI ISOLOTTI | NOME DELL’ARCIPELAGO | Area (ha) | Altitudine massima (metro) | Linea costiera (metri) | Distanza dalla costa (miglio nautico) | Coordinate geografiche | Proprietà | Isole con almeno uno status protetto | Presenza di un manager | |
| Latitudine | Longitudine | ||||||||||
| Arcipelago dei fiori e isole d’Ogliastra | Isola dei Cavoli | 42,7197 | 40 | 3708 | 39,0863401 | 9,53207838 | N/A | Commune de Villasimius | |||
| Scoglio di Sa Punta | 0,098716 | 0 | 39,2953485 | 9,63356596 | N/A | ||||||
| Scoglio di Cala sa Figu | 0,255067 | 10 | 39,3078857 | 9,62757655 | N/A | ||||||
| Scoglio di Cala is Cascias | 0,417627 | 0 | 39,0846647 | 9,536845 | N/A | ||||||
| Variglione settentrionale dei Cavoli | 0,895101 | 17 | 39,0836624 | 9,54109533 | N/A | ||||||
| Variglione meridionale dei Cavoli | 1,19888 | 14 | 39,0813744 | 9,53631471 | N/A | ||||||
| Variglione centrale dei Cavoli | 1,20526 | 14 | 39,0827831 | 9,53971565 | N/A | ||||||
| Scoglio su Brecconi | 0,610635 | 27 | 39,7045969 | 9,67144023 | N/A | ||||||
| Scoglio di San Elmo | 0,177716 | 3 | 39,0977683 | 9,52815227 | N/A | ||||||
| Scoglio Is Scoglius Arrubius,Scoglio di Arrubius | 0,134153 | 1 | 39,8720663 | 9,68531163 | N/A | ||||||
| Isola d’Ogliastra | 6,47821 | 47 | 1590 | 39,9750621 | 9,70467699 | N/A | |||||
| Scoglio meridionale dell’Isola d’Ogliastra | 0,536 | 3 | 320 | 39,9761124 | 9,70694446 | N/A | |||||
| Scoglio settentrionale dell’Isola d’Ogliastra | 0,875 | 3 | 220 | 39,976387 | 9,7080555 | N/A | |||||
| Scoglio di Murtas | 1,6525 | 12 | 290 | 1 | 39,5243528 | 9,65874378 | N/A | ||||
| Isola di Serpentara | 37,9342 | 54 | 3462 | 1 | 39,139467 | 9,60565285 | N/A | Commune de Villasimius | |||
| Variglione meridionale di Serpentara | 3,54197 | 32 | 630 | 1 | 39,1478588 | 9,60365376 | N/A | Commune de Villasimius | |||
| Variglione centrale di Serpentara | 1,53114 | 17 | 500 | 1 | 39,1493438 | 9,60552722 | N/A | Commune de Villasimius | |||
| Variglione settentrionale di Serpentara | 1,79641 | 27 | 440 | 1 | 39,1514957 | 9,6044453 | N/A | Commune de Villasimius | |||
| Scogli di Piscadeddus,Scogli de Piscadeddus,Scogli dei Pescatelli,Scogli Is Piscadeddus | 0,422837 | 12 | 160 | 39,1239185 | 9,46485149 | N/A | |||||
| Scoglio di Santo Stefano | 0,442316 | 13 | 290 | 39,1134337 | 9,49940276 | N/A | |||||
| Isole Tavolarine | Isola della Bocca | 0,593793 | 5 | 320 | 40,920554 | 9,5668058 | N/A | ||||
| Figarello,Isola di Figarolo | 22,2771 | 139 | 1957 | 40,9804412 | 9,64339062 | N/A | |||||
| Isola Gabbia | 1,50166 | 6 | 600 | 40,931013 | 9,52671687 | N/A | |||||
| Isola dei Garofani | 0,689366 | 5 | 265 | 40,8861134 | 9,63342108 | N/A | |||||
| L’Isoledda | 0,263726 | 15 | 170 | 40,8502796 | 9,69110595 | N/A | |||||
| Isolotti dei Pedrami | 2,31877 | 5 | 150 | 40,6847135 | 9,76640735 | N/A | |||||
| Isola di Leporeddu | 2,04243 | 2 | 210 | 40,9138137 | 9,50583471 | N/A | |||||
| Isola Manna | 3,6775 | 2 | 2000 | 40,9171633 | 9,51064154 | N/A | |||||
| Scoglio di Tramaglio | 0,096944 | 0 | 40,8305673 | 9,70740813 | N/A | ||||||
| Scoglio a nord di C.po Ceraso | 0,429925 | 0 | 40,9212757 | 9,6422252 | N/A | ||||||
| Isola di Molara | 348,887 | 161 | 40,8686151 | 9,72758974 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||||
| Scoglio dei Magroni | 0,241736 | 1 | 100 | 40,9233458 | 9,63548429 | N/A | |||||
| Isola di Mezzo | 2,29404 | 2 | 800 | 40,9212099 | 9,5119356 | N/A | |||||
| Isola di Patron Fiaso | 1,88499 | 4 | 640 | 40,9047062 | 9,58288988 | N/A | |||||
| Isolotto I Porri | 2,48752 | 9 | 500 | 40,9586729 | 9,58858547 | N/A | |||||
| Isolotto di Porritula | 0,483496 | 3 | 130 | 40,9853387 | 9,588876 | N/A | |||||
| Isola settentrionale di Portolucas | 0,913597 | 8 | 340 | 40,9214143 | 9,63373448 | N/A | |||||
| Isola meridionale di Portolucas | 0,646213 | 7 | 250 | 40,9202239 | 9,63273075 | N/A | |||||
| Isola Rossa,Isola Ruja di C.po Comino | 5,98895 | 5 | 1200 | 40,539196 | 9,81923399 | N/A | |||||
| Isola di Tavolara | 604,206 | 565 | 19996 | 1 | 40,9057123 | 9,71290054 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isola Piana | 13,7857 | 14 | 2017 | 40,8882354 | 9,6508792 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isola dei Cigni,Isola dei Cavalli | 2,32697 | 5 | 791 | 40,8855873 | 9,64031906 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isoletta di Cala Spagnola,Isolotto del Fico | 0,51347 | 1 | 301 | 1 | 40,875298 | 9,707768 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isolotti dei Tre Fratelli | 0,280086 | 1 | 90 | 1 | 40,8617504 | 9,76169124 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isola di Molarotto | 2,88183 | 51 | 981 | 3 | 40,8744899 | 9,77797881 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isola Cana | 0,611015 | 6 | 327 | 40,8644704 | 9,67699041 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Reulino,Isolotto Rosso | 2,47876 | 11 | 824 | 40,8777385 | 9,67166861 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isola dei Porri di Tavolara,Isolotto Spalmatore | 0,35383 | 6 | 254 | 1 | 40,893745 | 9,668171 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isola dei Topi | 0,273234 | 5 | 192 | 1 | 40,8967373 | 9,67502944 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | |||
| Isola di Barca Sconcia | 0,699681 | 6 | 477 | 40,9176583 | 9,64744332 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isolotto di Ottiolu | 0,878777 | 5 | 340 | 40,7363447 | 9,71811452 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isola Ruja,Isola Rossa | 3,05304 | 14 | 700 | 40,8276895 | 9,70791501 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isola di Proratora | 4,85692 | 27 | 1017 | 40,8464566 | 9,72332668 | N/A | Consortium de 3 communes (Olbia, S. Teodoro et Loiri S. Paolo) – Area marina protetta Tavolara-Punta | ||||
| Isola del Cavallo | 1,54934 | 4 | 550 | 40,9171863 | 9,52605347 | N/A | |||||
| Scoglio settentrionale di Leporeddu | 0,541 | 240 | 40,915554 | 9,50583361 | N/A | ||||||
| Arcipelago di La Maddalena | Scoglio della Colombaia | 0,614922 | 7 | 190 | 41,2327921 | 9,27928664 | N/A | ||||
| Isola dei Cappuccini | 3,11352 | 23 | 872 | 41,1531822 | 9,50202198 | N/A | |||||
| Isolotto dei Fichi d’India | 0,231 | 170 | 41,125724 | 9,444342 | N/A | ||||||
| Isola dei Cavalli | 0,744807 | 0 | 300 | 41,2023976 | 9,31807673 | N/A | |||||
| Isolotto di Porto Puddu | 4,2602 | 16 | 920 | 41,1903467 | 9,3333133 | N/A | |||||
| Isolotto dei Mucchi Bianchi | 0,37 | 8 | 200 | 41,126667 | 9,46583361 | N/A | |||||
| Scoglio Munichedda | 5,4938 | 12 | 950 | 41,250415 | 9,1841979 | N/A | |||||
| Isola della Maddalena | 1973,52 | 156 | 49314 | 41,2329377 | 9,41013323 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola di Caprera | 1587,91 | 212 | 50347 | 41,2100644 | 9,46517017 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola di Santo Stefano | 303,413 | 100 | 11202 | 41,1968212 | 9,41149146 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola di Spargi | 423,556 | 153 | 12650 | 1 | 41,2410174 | 9,34562784 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Spargiotto | 10,3414 | 47 | 1743 | 2 | 41,2504167 | 9,32399423 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Budelli | 172,873 | 88 | 8835 | 4 | 41,2829692 | 9,34951218 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Razzoli | 166,121 | 65 | 12168 | 5 | 41,3010087 | 9,3462786 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Santa Maria | 188,241 | 49 | 11003 | 4 | 41,2976249 | 9,37351044 | N/A | Autorité du parc national de La Maddalena | |||
| Isola La Presa | 28,961 | 0 | 2839 | 6 | 41,3100408 | 9,37560646 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Corcelli | 12,7629 | 32 | 2295 | 5 | 41,2947544 | 9,40031094 | N/A | Autorité du parc national de La Maddalena | |||
| Isola Piana | 4,12081 | 10 | 810 | 5 | 41,2948314 | 9,40547755 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Barrettini | 10,7275 | 39 | 2076 | 4 | 41,2834089 | 9,40184237 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto settentrionale Barrettinelli | 0,095694 | 0 | 280 | 4 | 41,2762953 | 9,40379183 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Soffi | 45,44 | 30 | 3000 | 1 | 41,0646656 | 9,57487682 | N/A | Autorité du parc national de La Maddalena | |||
| Isola occidentale delle Camere | 3,75223 | 22 | 1000 | 1 | 41,068157 | 9,5818262 | N/A | Autorité du parc national de La Maddalena | |||
| Isola orientale delle Camere | 5,2099 | 16 | 1200 | 1 | 41,0699671 | 9,5863968 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Mortorio | 63,3231 | 77 | 6712 | 1 | 41,0762034 | 9,60443372 | N/A | Autorité du parc national de La Maddalena | |||
| Isole Poveri | 0,145698 | 3 | 390 | 41,094081 | 9,580921 | N/A | Autorité du parc national de La Maddalena | ||||
| Capaccia | 0,027 | 10 | 41,094049 | 9,584961 | N/A | Autorité du parc national de La Maddalena | |||||
| Isola delle Rocche | 2,62786 | 17 | 640 | 41,1165884 | 9,56922112 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola occidentale Li Nibani | 7,8219 | 20 | 2000 | 41,1261891 | 9,56610316 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola delle Bisce | 29,5765 | 16 | 3442 | 41,164443 | 9,52303717 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola del Porco | 5,38094 | 25 | 1205 | 1 | 41,1742718 | 9,46098137 | N/A | Autorité du parc national de La Maddalena | |||
| Isola del Piccolo Porco | 0,374978 | 7 | 245 | 1 | 41,1743045 | 9,45939409 | N/A | Autorité du parc national de La Maddalena | |||
| Isola della Pecora | 7,23188 | 16 | 1392 | 2 | 41,1825507 | 9,4857012 | N/A | Autorité du parc national de La Maddalena | |||
| Isola della Piccola Pecora | 0,03997 | 5 | 205 | 2 | 41,1838795 | 9,48781791 | N/A | Autorité du parc national de La Maddalena | |||
| Isole dei Monaci | 1,83214 | 12 | 1179 | 3 | 41,2170047 | 9,51808546 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto settentrionale Italiani | 0,167 | 240 | 3 | 41,22967 | 9,45456 | N/A | Autorité du parc national de La Maddalena | ||||
| Isolotto centrale Italiani | 0,444924 | 5 | 288 | 3 | 41,2285952 | 9,4551857 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto meridionale Italiani | 0,904672 | 8 | 412 | 3 | 41,2257522 | 9,4555621 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto dell’Aglio | 0,319631 | 3 | 230 | 2 | 41,2080146 | 9,44656229 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto Roma | 1,7126 | 20 | 520 | 41,1964298 | 9,3966348 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola Chiesa | 7,13474 | 16 | 1200 | 2 | 41,2132235 | 9,41779164 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Giardinelli | 47,0423 | 16 | 4000 | 3 | 41,2321175 | 9,44124624 | N/A | Autorité du parc national de La Maddalena | |||
| Isola Lo Strangolato | 0,067 | 120 | 3 | 41,2569427 | 9,40583318 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola di Abbatoggia | 2,10804 | 14 | 778 | 3 | 41,2532019 | 9,39941548 | N/A | Autorité du parc national de La Maddalena | |||
| Isola Carpa | 0,420026 | 9 | 276 | 4 | 41,2875662 | 9,36249495 | N/A | Autorité du parc national de La Maddalena | |||
| Isola settentrionale di Paduleddi | 1,86146 | 12 | 569 | 4 | 41,2864967 | 9,36659381 | N/A | Autorité du parc national de La Maddalena | |||
| Isola meridionale di Paduleddi | 0,479572 | 7 | 289 | 4 | 41,2855122 | 9,3653185 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di mezzo Stramanari | 0,298533 | 5 | 200 | 4 | 41,283352 | 9,36392755 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Capicciolu | 1,7229 | 49 | 566 | 6 | 41,3090649 | 9,36918879 | N/A | Autorité du parc national de La Maddalena | |||
| Scoglio di Cala Giorgio Marino,Cala Giorgio Marino | 0,038698 | 0 | 70 | 5 | 41,275077 | 9,40277669 | N/A | Autorité du parc national de La Maddalena | |||
| Barretinelli di Fuori,Isola di Barretinelli di Fuori | 0,51877 | 11 | 290 | 5 | 41,3014381 | 9,40108057 | N/A | Autorité du parc national de La Maddalena | |||
| Isola di Punta Stagnali,Punta Stagnali | 0,782954 | 5 | 434 | 1 | 41,2017863 | 9,44257588 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto di P. Coda Sardegna,Isola Fico | 0,250208 | 1 | 160 | 41,1879052 | 9,43350842 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola di Mortorietto | 0,548151 | 3 | 180 | 2 | 41,0859015 | 9,61852495 | N/A | Autorité du parc national de La Maddalena | |||
| Isola meridionale dei Poveri | 2,34045 | 3 | 250 | 41,09221 | 9,57918332 | N/A | Autorité du parc national de La Maddalena | ||||
| Scoglio di Punta Abbatoggia | 0,365465 | 0 | 238 | 3 | 41,2620935 | 9,40073159 | N/A | Autorité du parc national de La Maddalena | |||
| Scoglio meridionale di Abbatoggia | 1,17252 | 5 | 292 | 2 | 41,249638 | 9,396667 | N/A | Autorité du parc national de La Maddalena | |||
| Stramanari est | 9 | 160 | 4 | 41,2494431 | 9,39777756 | N/A | Autorité du parc national de La Maddalena | ||||
| Isola orientale di Stramanari | 0,127993 | 9 | 174 | 4 | 41,2834682 | 9,36511914 | N/A | Autorité du parc national de La Maddalena | |||
| Scoglio di Spargiotello | 0,098794 | 0 | 41,251659 | 9,32096424 | N/A | ||||||
| Scoglio della Torre | 0,128493 | 0 | 41,0156309 | 8,87220651 | N/A | ||||||
| Isolotto centrale di Cala Lunga | 0,135967 | 2 | 41,2947588 | 9,33483678 | N/A | ||||||
| Isola settentrionale di Cala Lunga | 0,145791 | 0 | 41,2951485 | 9,33280629 | N/A | ||||||
| Isola Molino | 0,16599 | 3 | 40,9191082 | 8,71041486 | N/A | ||||||
| Isolotto orientale di Cala Lunga | 0,452624 | 0 | 41,2946877 | 9,33591039 | N/A | ||||||
| Isolotto Camize | 0,462223 | 3 | 41,0743883 | 9,58733458 | N/A | ||||||
| Scoglio di Cala di Trana | 0,523119 | 0 | 41,2862436 | 9,33715218 | N/A | ||||||
| Scoglio di Punta Corsara | 0,707959 | 12 | 41,2285869 | 9,33764487 | N/A | ||||||
| Isolotto del Canale delle Galere | 0,958144 | 8 | 41,1227381 | 9,56525845 | N/A | ||||||
| Isola settentrionale Li Nibani | 2,53135 | 16 | 41,131201 | 9,56723542 | N/A | ||||||
| Scoglio Li Canneddi | 0,434638 | 0 | 41,0264923 | 8,8787809 | N/A | ||||||
| Scoglio di Tinnari | 0,847785 | 0 | 41,0281647 | 8,89201759 | N/A | ||||||
| Scoglio di Porto Leccio | 0,321344 | 0 | 41,0441704 | 8,92679204 | N/A | ||||||
| Scoglio di Costa Paradiso | 0,329023 | 0 | 41,0575688 | 8,94528844 | N/A | ||||||
| Scoglio la Cruzzitta | 0,114173 | 3 | 41,0767127 | 8,96544889 | N/A | ||||||
| Isola settentrionale della Marmorata | 3,00149 | 3 | 41,2564049 | 9,24066736 | N/A | ||||||
| Isola occidentale di Stramanari | 0,151419 | 3 | 41,2840851 | 9,36274174 | N/A | ||||||
| Scoglio di Punta Falcone | 0,529719 | 0 | 41,2588861 | 9,22439459 | N/A | ||||||
| Isolotto Cala del Rosario | 0,224278 | 0 | 41,3102083 | 9,33616961 | N/A | ||||||
| Scoglio meridionale di Calaccia | 0,178636 | 0 | 41,3015651 | 9,33384444 | N/A | ||||||
| Isolotto delle Bisce | 1,21691 | 4 | 41,1638329 | 9,5185912 | N/A | ||||||
| Isolotto meridionale di Cala Lunga | 0,371772 | 0 | 41,2939847 | 9,33574794 | N/A | ||||||
| Scoglio della Noce | 0,550765 | 0 | 41,3012284 | 9,35639304 | N/A | ||||||
| Scoglio di C.po Testa | 0,450847 | 4 | 41,2315218 | 9,14100972 | N/A | ||||||
| Isolotto di Punta Barca Bruciata | 0,44247 | 5 | 41,1404256 | 9,43804233 | N/A | ||||||
| Scoglio di Cala Baccà | 0,081623 | 6 | 41,1911684 | 9,44185064 | N/A | ||||||
| Scoglio Colombo | 0,499841 | 4 | 41,2415896 | 9,26729599 | N/A | ||||||
| Scoglio Paganetto | 0,579319 | 1 | 41,2447506 | 9,27042978 | N/A | ||||||
| Scoglio settentrionale di Calaccia | 0,07 | 41,3031528 | 9,33376283 | N/A | |||||||
| Scoglio di Monte Russu | 0,827625 | 0 | 350 | 41,1578573 | 9,11959288 | N/A | |||||
| Isola meridionale della Marmorata | 5,49194 | 5 | 900 | 41,2534369 | 9,23812694 | N/A | |||||
| Isolotto dell’Oro | 0,11 | 130 | 41,18057 | 9,397254 | N/A | ||||||
| Isola di Portisco | 1,31886 | 5 | 380 | 41,0418531 | 9,52877021 | N/A | |||||
| Isola Rossa | 6,36269 | 29 | 1406 | 41,0140768 | 8,86313879 | N/A | |||||
| Scoglio occidentale dell’Isola Rossa | 0,391177 | 0 | 210 | 41,0154619 | 8,85966597 | N/A | |||||
| Isolotto meridionale di Punta Scaviccio | 2,06929 | 8 | 650 | 2 | 41,2216988 | 9,44893896 | N/A | Autorité du parc national de La Maddalena | |||
| Isolotto di Cala Scaviccio | 0,800814 | 2 | 380 | 2 | 41,2186276 | 9,44934314 | N/A | Autorité du parc national de La Maddalena | |||
| Isole della Costa del Sud | Isola di Campionna | 0,631916 | 16 | 334 | 38,9144613 | 8,765562 | N/A | ||||
| Isola del Coltellazzo,Isolotto di Coltellazzo | 0,527621 | 11 | 375 | 38,9848238 | 9,02352851 | N/A | |||||
| Isole Ferraglione orientale | 0,989104 | 8 | 360 | 38,8818664 | 8,8269445 | N/A | |||||
| Isole Ferraglione occidentale | 0,686904 | 14 | 300 | 38,8814759 | 8,8249404 | N/A | |||||
| Isola di Padiglioni | 0,302637 | 4 | 190 | 38,8760697 | 8,83468763 | N/A | |||||
| Isola di Teulada,Isola Rossa di Punta Niedda | 10,8358 | 43 | 1715 | 38,9145691 | 8,71648174 | N/A | |||||
| Isola Su Giudeu | 1,34482 | 18 | 400 | 38,8819519 | 8,86468385 | N/A | |||||
| Isola di San Macario | 2,02339 | 29 | 582 | 39,0036332 | 9,03223971 | N/A | |||||
| Isola di Tuarreda | 4,45846 | 32 | 1092 | 38,8915874 | 8,81310453 | N/A | |||||
| Scoglio di Tuarredda | 0,2982 | 8 | 230 | 38,8890518 | 8,81126492 | N/A | |||||
| Scoglio Sant’Elia | 0,168558 | 0 | 39,1836555 | 9,14243626 | N/A | ||||||
| Arcipelago Sulcitano | Scoglio Mannu,Isola dei Meli | 1,37952 | 11 | 680 | 39,2270317 | 8,35618302 | N/A | ||||
| Isola di San Pietro,I. S. Pietro | 5100,99 | 211 | 1075 | 39,1405577 | 8,27561624 | N/A | |||||
| Isola Piana del Sulcis | 22,042 | 19 | 2000 | 2 | 39,1914916 | 8,32032282 | N/A | ||||
| Isola dei Ratti | 1,3221 | 6 | 580 | 2 | 39,1857436 | 8,31896478 | N/A | ||||
| Isola del Corno | 0,498771 | 15 | 190 | 7 | 39,1473233 | 8,20786114 | N/A | ||||
| Isola della Vacca | 9,28179 | 94 | 1415 | 6 | 38,936328 | 8,44969638 | N/A | ||||
| Scoglio del Vitello | 0,249386 | 10 | 200 | 6 | 38,9411547 | 8,45035763 | N/A | ||||
| Isola del Toro | 13,4838 | 112 | 1468 | 10 | 38,8615708 | 8,41048442 | N/A | ||||
| Isola di Sant’Antioco | 10947,7 | 273 | 39,0418123 | 8,41016317 | N/A | ||||||
| Isolotto di Cala Saboni | 0,466605 | 5 | 39,0062411 | 8,38273061 | N/A | ||||||
| Scoglio Su Scoglieddu | 0,17824 | 0 | 39,1998909 | 8,36939768 | N/A | ||||||
| Isolotto a Punta Trettu | 3,16547 | 1 | 39,1050332 | 8,43793357 | N/A | ||||||
| Scoglio Mangiabarche di Terra | 0,206545 | 6 | 39,0759101 | 8,34897295 | N/A | ||||||
| Scoglio Mangiabarche di Fuori | 0,174676 | 8 | 39,0766994 | 8,34535306 | N/A | ||||||
| Scoglio di Cala Lunga | 0,112623 | 0 | 39,0178215 | 8,36830807 | N/A | ||||||
| Isolotto del Genio | 0,240177 | 1 | 39,0947593 | 8,28260029 | N/A | ||||||
| Isola di Calavinagra | 0,954153 | 22 | 39,1664678 | 8,24259464 | N/A | ||||||
| Isola di Stea | 0,533555 | 16 | 39,1751567 | 8,26285884 | N/A | ||||||
| Isole dell’Iglesiente | Scoglio il Morto | 0,342046 | 33 | 39,3050458 | 8,43216131 | N/A | |||||
| Scoglio meridionale l’Agusteri | 0,438391 | 35 | 39,3122175 | 8,42691258 | N/A | ||||||
| Scoglio l’Agusteri | 0,19305 | 36 | 39,3162326 | 8,42436758 | N/A | ||||||
| Isola di Pan di Zucchero | 4,99746 | 133 | 39,3338934 | 8,40000129 | N/A | ||||||
| Isolotto di Buggerru | 0,008 | 5 | 39,4077776 | 8,40348239 | N/A | ||||||
| Isole del Sinis | Isola Caogheddas | 0,255334 | 0 | 290 | 39,9042997 | 8,39646049 | N/A | ||||
| Isolotto Sa Mesa Longa | 1,14725 | 7 | 350 | 40,0461889 | 8,39683831 | N/A | |||||
| Isola di Mal di ventre | 88,549 | 18 | 6827 | 3 | 39,9904952 | 8,30523054 | N/A | ||||
| Scoglio meridionale di S’Archittu | 0,202609 | 8 | 40,0923084 | 8,48699138 | N/A | ||||||
| Scoglio settentrinale di S’Archittu | 0,62742 | 1 | 40,0930738 | 8,48753441 | N/A | ||||||
| Isola di Sa Tonnara | 1,70092 | 10 | 420 | 40,0538159 | 8,40369236 | N/A | |||||
| Isole della Costa di Bosa | Scoglio di Poglina | 0,445225 | 0 | 40,4997443 | 8,33678662 | N/A | |||||
| Scoglio centrale di Corona Niedda | 1,70941 | 21 | 470 | 40,2100117 | 8,45545786 | N/A | |||||
| Isolotto Sa Pagliosa | 1,05939 | 19 | 370 | 40,360349 | 8,37739843 | N/A | |||||
| Scoglio di Marargiu | 0,125101 | 0 | 40,3376723 | 8,38180325 | N/A | ||||||
| Isolotto di Porto Managu | 1,59225 | 30 | 40,3354462 | 8,42161163 | N/A | ||||||
| Scoglio di Torre Argentina | 0,542502 | 11 | 40,3205699 | 8,44192272 | N/A | ||||||
| Scoglio di Colombargia | 0,621638 | 5 | 40,232617 | 8,46299213 | N/A | ||||||
| Scoglio settentrionale di Corona Niedda | 0,778223 | 22 | 40,2127718 | 8,45873479 | N/A | ||||||
| Scoglio meridionale di Corona Niedda | 0,723 | 40,2039676 | 8,45793919 | N/A | |||||||
| Isole della Riviera del Corallo | Isola di Foradada | 5,41254 | 131 | 1290 | 40,5706297 | 8,1516413 | N/A | ||||
| Isola Piana di Capo Caccia | 13,3826 | 105 | 1785 | 40,6038133 | 8,14096201 | N/A | Commune d’Alghero | ||||
| Isola della Maddalena | 0,910898 | 4 | 40,5722873 | 8,30018509 | N/A | ||||||
| Arcipelago dell’Asinara | Isolotti del Candelliere | 0,451 | 10 | 160 | 5 | 41,0513878 | 8,250556 | N/A | Autorité du parc national de L’Asinara | ||
| Isola Sgombro,Isola Scombro | 3,36171 | 12 | 700 | 4 | 41,0284714 | 8,25210596 | N/A | Autorité du parc national de L’Asinara | |||
| Isolotto Bocca | 0,897056 | 0 | 400 | 40,9855355 | 8,21378468 | N/A | Autorité du parc national de L’Asinara | ||||
| L’Isolotto | 0,786955 | 2 | 450 | 40,9672502 | 8,22472465 | N/A | Autorité du parc national de L’Asinara | ||||
| Isola Piana dell’Asinara,Piana di Stintino | 120,709 | 23 | 6500 | 40,9751019 | 8,21841957 | N/A | Autorité du parc national de L’Asinara | ||||
| Isola della Pelosa | 2,04463 | 7 | 580 | 40,9707138 | 8,20697015 | N/A | Autorité du parc national de L’Asinara | ||||
| Scoglio di Punta Pedra Bianca | 0,212238 | 0 | 40,9999088 | 8,21085192 | N/A | ||||||
| Scoglio di Scombro di Dentro | 0,515551 | 0 | 41,0278463 | 8,24614709 | N/A | ||||||
| Scoglio occidentale di Scoglio Andrea | 0,537769 | 0 | 41,0239526 | 8,25399432 | N/A | ||||||
| Scoglio di Cala Galanza | 0,653212 | 16 | 41,0072896 | 8,21295298 | N/A | ||||||
| Scoglio di Punta Scoglietti | 0,754156 | 15 | 40,9393212 | 8,17406474 | N/A | ||||||
| Scoglio orientale di Scoglio Andrea | 0,983593 | 7 | 41,0238423 | 8,25552925 | N/A | ||||||
| Asinara,Isola dell’Asinara | 5172,55 | 408 | 41,062805 | 8,269777 | N/A | ||||||
| Scoglio di Businco | 0,570932 | 20 | 300 | 40,8253118 | 8,18778148 | N/A | |||||
| Isola dei Porri,Isolotto dei Porri | 4,08946 | 63 | 832 | 40,8805385 | 8,2136562 | N/A | |||||



